独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)エネルギー技術研究部門【研究部門長 長谷川 裕夫】エネルギー界面技術研究グループ 周 豪慎 研究グループ長、独立行政法人 日本学術振興会(JSPS)外国人特別研究員 王 永剛は、新しい構造の大容量リチウム-空気電池を開発した。
携帯電話やノートパソコンなどにリチウムイオン電池は広く使われているが、電気自動車用にはエネルギー密度が不足している。そのため理論的に大容量化が可能と予測されている「リチウム-空気電池」が次世代の大容量電池として注目されている。しかし今までに報告されているリチウム-空気電池は、正極に固体の反応生成物が蓄積し電解液と空気の接触が遮断され放電が止まるなどの問題があった。
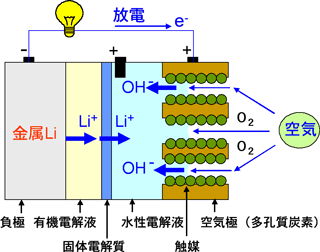
本研究においては、負極(金属リチウム)側に有機電解液を、正極(空気)側に水性電解液を用い、両者を固体電解質で仕切り、両電解液の混合を防いだ。固体電解質はリチウムイオンのみを通すため、電池反応は支障なく進み、正極における反応生成物は水溶性であり固体物質は生成しない。この電池の連続50000mAh/g(空気極の単位質量あたり)の放電も実験により確認した。
本技術は自動車用電池として極めて有望である。自動車用のスタンドで、正極の水性電解液を入れ替え、負極側の金属リチウムをカセットなどの方式で補給すれば、自動車は充電の待ち時間なく連続走行できる。使用済みの水性電解液からは電気的に容易に金属リチウムが再生され、リチウムは繰り返し使用される。金属リチウムを燃料とした新型燃料電池といえる。
本研究成果は、2009年3月31日に京都で開催される電気化学会で発表される。
 |
 |
|
左図:今回開発の「リチウム-空気電池」の構成
上図:従来電池と正極放電容量の比較 正極の単位質量(グラム)当たりのミリアンペア時間 空気極の質量=(多孔質炭素+触媒+バインダー)、リチウムイオン電池の正極の質量=(活物質+導電助剤+バインダー)で計算
|
近年、化石燃料の消費にともなう二酸化炭素排出量の増加や、原油価格の激しい変化などを背景に、自動車のエネルギー源をガソリンや軽油から電気エネルギーに転換していくことが注目されている。電気自動車の実用化はすでに一部進みつつあるが、長距離走行のために蓄電池としてのリチウムイオン電池の高性能化と低コスト化が期待されている。しかしながら、現状のリチウムイオン電池では、電池容量に制約があり長距離走行が困難であること、またそのため大量の電池を自動車に搭載する必要があることから、車体価格が大幅に上昇するという問題があった。
電気自動車の普及のためには、現在のレベルの約6~7倍のエネルギー密度が必要となる。そこで、理論上、リチウムイオン電池よりもはるかに大きいエネルギー密度を有する金属リチウム-空気電池が注目されている。この電池では、正極で空気中の酸素を活物質として用いるので、理論的には正極の容量が無限となり、大容量を実現することができる。
産総研エネルギー技術研究部門では、次世代「リチウムイオン電池」を目指して、電極材料をナノ構造化することで、大出力化が期待できることを示してきた(2005年1月18日、2007年11月19日、2008年8月27日産総研プレス発表)。自動車用にはさらなる大幅なエネルギー密度のアップが必要となるので「リチウム-空気電池」の研究も精力的に進めてきた。
 |
従来のリチウム-空気電池の問題点
|
1) |
正極に固体の反応生成物(Li2O)が蓄積し細孔を目詰まりさせ、放電が止まる。 |
|
2) |
空気中の水分が金属リチウムと反応すると危険な水素ガスを発生する。 |
|
3) |
空気中の窒素が金属リチウムと反応して放電を妨害する懸念がある。 |
|
|
|
図1 従来のリチウム-空気(酸素)電池の原理図
|
産総研では、従来の電池の問題点を踏まえ、負極側に金属リチウムと有機電解液、正極側に空気極と水性電解液、両電解液の隔壁として固体電解質に着目し研究開発を行ってきた。
今回の研究の一部は、独立行政法人 日本学術振興会(JSPS)の科学研究費補助金により行われた。
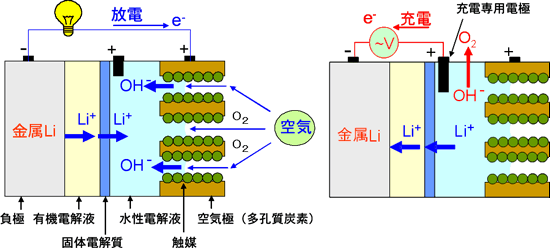
本研究は、金属リチウムの負極側にのみ有機電解液を用い、正極の空気極側では水性電解液を使うという着想を基にしている。負極側の有機電解液と空気極側の水性電解液の間に、リチウムイオンのみを通す固体電解質を隔壁として使用すれば両電解液の混合を防ぐことができ、かつ電池反応を進めることができる。これによって、正極での固体反応生成物である酸化リチウム(Li2O)の析出を防げることを発見した。すなわち、この電池では、放電反応により生成するのは固体の酸化リチウム(Li2O)ではなくて、水性電解液に溶けやすい水酸化リチウム(LiOH)であり、空気極のカーボン細孔の目詰まりは起こらない。また、水や窒素などは固体電解質の隔壁を通れないため、負極のリチウム金属と反応する危険性がない。さらに、充電するときには、充電専用の正極を配置することにより、充電による空気極の腐食と劣化を防ぐことができる。
 |
|
図2 新しい構造の「リチウム-空気電池」の構成 左図:放電時 右図:充電時
|
負極として金属リチウムリボンを、負極用電解液としてリチウム塩を含む有機電解液を組み合わせる。正極と負極を分離する隔壁としてリチウムイオン固体電解質を中央に配置する。正極用の水性電解液としてアルカリ性の水溶性ゲルを用い、微細化カーボンと安価な酸化物触媒で形成された正極と組み合わせた。
放電時の電極における反応は次のようになる。
1)負極での反応:Li → Li
+ + e
-
金属リチウムがリチウムイオン(Li+)として有機電解液に溶解し、電子は導線に供給される。溶解したリチウムイオン(Li+)は固体電解質を通り抜けて正極の水性電解液に移動する。
2)正極での反応:O
2 + 2H
2O + 4e
- → 4OH
-
導線から電子が供給されて微細化カーボンの表面で空気中の酸素と水が反応して水酸イオン(OH-)が生じる。正極の水性電解液においてリチウムイオン(Li+)と出会って水溶性の水酸化リチウム(LiOH)となる。
充電時の電極における反応は次のようになる。
1)負極での反応:Li
+ + e
- → Li
導線から電子が供給され、リチウムイオン(Li+)は正極の水性電解液から固体電解質を通り抜けて負極表面に達し、そこで金属リチウムの析出反応が起こる。
2)正極での反応:4OH
- → O
2 + 2H
2O + 4e
-
酸素発生反応が生じる。発生した電子は導線に供給される。
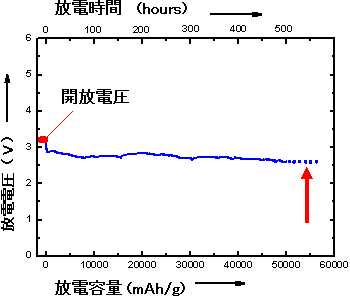
今回新たに開発したアルカリ性水性電解質ゲルを用いたリチウム-空気電池を、空気中で0.1A/gの放電レートで放電すると、放電容量は約9000mAh/gとなった。また、充電容量も約9600mAh/gとなった。この放電容量は、これまでに報告されている従来型のリチウム-空気電池の容量(700~3000 mAh/g)に比べると、大幅に増加している。さらに、アルカリ性水溶性ゲルの代わりにアルカリ性水溶液を使うと、空気中で0.1A/gの放電レートの放電で、図3に示すように連続的に20日間の放電ができ、その放電容量は約50000mAh/gとなった。
 |
|
図3 新しい構造の「リチウム-空気電池」の長時間連続放電曲線
|
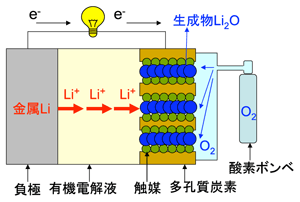
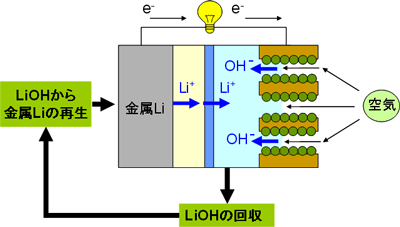
この新しいリチウム-空気電池は、放電が終わった後に充電する代わりに、正極の水性電解液を入れ替え、負極側の金属リチウムをカセットなどの方式を利用して入れ替えれば、連続使用可能になる。これは一種の燃料電池であり、「金属リチウム燃料電池」と呼ぶことができる。理論的には金属リチウム30キログラムはガソリン40リットルとほぼ同じエネルギーを持っている。空気極側で生成した水酸化リチウム(LiOH)を使用済みの水性電解液から回収すれば、電気的に金属リチウムを再生するのは容易であり、燃料として再利用できる。リチウムが循環使用される「金属リチウム燃料電池」のコンセプトを図4に示す。
 |
|
図4 リチウムが循環使用される「金属リチウム燃料電池」のコンセプト
|
今回、産総研が開発した新しい構造の新型「リチウム-空気電池」は、実用化に向けて技術の向上がさらに必要であり、充電可能な電池として、また大容量連続放電が可能な「リチウム燃料電池」として、さらなる研究開発を進める予定である。