独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)エネルギー技術研究部門【研究部門長 長谷川 裕夫】エネルギー界面技術研究グループ 周 豪慎 研究グループ長、王 永剛 産総研特別研究員は、リチウムと水の電気化学反応を制御することによりクリーンな水素を製造するシステムを考案し、その実証に成功した。
近年、化石燃料の消費に伴う二酸化炭素排出量の増加を抑制するため、クリーンなエネルギー源としての水素が注目されている。しかし、水素をエネルギーとして利用するには、多くの課題があり、特に水素を安全・簡便に貯蔵する技術の確立が求められている。したがって水素を必要とされるサイトで需要に応じて製造することができれば、安全・簡便の観点から望ましい。
以前に、リチウム金属を負極側、水を正極側の活物質として用いる、リチウム-水電池と呼ばれる装置のアイデアがあったが、副生する水素の利用は考慮されていなかった。周らは、金属リチウム負極と炭素正極を組み合わせ、これに電解液としてハイブリッド電解液(=有機電解液/固体電解質/水性電解液)を用いることにより、安定に制御された反応により、水素と電力を同時に製造する新しいコンセプトを考案し、今回システムとして実証することに成功した。このシステムを用いれば、電気化学反応に伴う放電により発生する電気と同時に、クリーンな水素を必要なときに必要な量だけ製造することができる。現時点で、正極1cm2あたりの水素製造量は約230 µmol/hである。本システムは充電により再生できるため、太陽電池など自然エネルギーや夜間の余剰電力を利用して金属リチウムの形でエネルギーを貯蔵し、必要に応じて水素と電力を取り出すエネルギー貯蔵システムとしての利用が可能である。今後、本システムの最適な利用形態などをさらに検討していく予定である。
本成果は、2010年5月14日にドイツの学術誌ChemSusChemにHighlightとして掲載される。
 |
 |
|
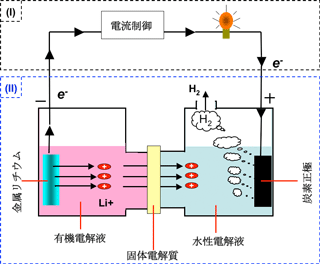
左図:リチウム-水電池と水素製造のイメージ
|
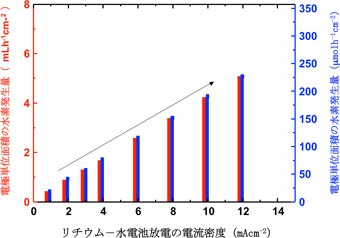
右図:リチウム-水電池正極から製造した水素の量
|
化石燃料の大量消費に伴う二酸化炭素排出量の増加や、原油価格の激しい変動などが起こる中、持続可能な低炭素社会を構築するために、水素エネルギーの有効利用が注目されている。しかし、水素を本格的なエネルギーとして使う水素エネルギー社会を実現するために、革新的な水素製造技術とエネルギー貯蔵技術の確立が求められている。
産総研エネルギー技術研究部門では、リチウムイオン電池の開発過程で、電極材料をナノ構造化することにより、電池の大出力化が期待できることを示してきた(2005年1月18日、2007年11月19日、2008年8月27日 産総研プレス発表)。また、さらに大幅なエネルギー密度の向上を目指してリチウムのリサイクルなどが可能なリチウム-空気電池とリチウム-銅二次電池(2009年2月24日、2009年8月24日 産総研プレス発表)の研究も進めてきた。
今回新たに、ハイブリッド電解液を活用したリチウム-水の電気化学反応に着目し、エネルギー需給に応じて、発電しながら水素を製造するシステムを着想した。
リチウム-空気電池やリチウム-銅二次電池で用いた、ハイブリッド電解液のコンセプトを応用して、金属リチウムを負極側活物質、水を正極側の活物質とし、正極集電体としてカーボンを使い、負極側の有機電解液と正極側の水性電解液との間に、リチウムイオン(Li+)だけを通す固体電解質をセパレーターとして使用するシステムを構築した。この構成によって、両電解液の混合を防ぐことができ、かつ水素イオン(H+)あるいは水酸化物イオン(OH-)が有機電解液に到達しないため、リチウムと水の電気化学反応を制御することが可能となった。
放電時の電極反応は次のようになる。
1) 負極での反応:Li → Li+ + e-
金属リチウム(Li)がリチウムイオンとして有機電解液に溶解し、電子(e-)は配線に供給される。リチウムイオンは固体電解質を通り正極側の水性電解液に移動する。
2) 正極での反応:2H2O + 2e- → 2OH- + H2(gas)
配線から電子が供給され、活物質の水が分解し、正極の集電体付近から水素(H2)が発生する。
このように本システムにおける水素の生成は、リチウム-水電池における放電反応に伴うもので、放電電流量を制御することにより水素の製造速度を制御することができる。現時点で、電流密度12 mA/cm2で放電すると、正極集電体の水素製造量は約5.2 mL/h/cm2(約230 µmol/h/cm2)である。固体電解質セパレーターのリチウムイオン伝導率の向上と作動温度を上げることにより、数十倍の水素製造能力向上が見込まれる。
本システムは放電の逆反応によって(充電)、生成物の水酸化リチウム(LiOH)を回収でき、システムとして再利用できるため、風力や太陽電池など変動する再生可能エネルギーや夜間の余剰電力をリチウムの形で貯蔵し、需要に応じてリチウム-水電池の放電電流量を制御して水素と電力を取り出すことができる。太陽光発電などを利用すれば電力ネットワークが届いていない地域の住宅用エネルギーの貯蔵と供給システムとしての利用も可能であろう。
今回開発したリチウムと水の反応制御による水素製造のシステムは、まだ実験室レベルのものであり、実用化のために、固体電解質のリチウムイオン伝導率の向上と耐久性の改善を目指す。また電気と水素を同時に供給できる点、また充電反応により再生できる点などの本システムの特徴をどのように活用すれば、将来のエネルギー技術体系の中で貢献できるのか、今後さらに検討を進めていく予定である。