- 免疫グロブリンG(IgG)を発光反応の触媒とする天然ルシフェリンの改変体を開発
- IgGの構造に応じて発光色を変化させることに成功
- 変性度を迅速・簡便に判定できるため、抗体の品質管理への応用に期待
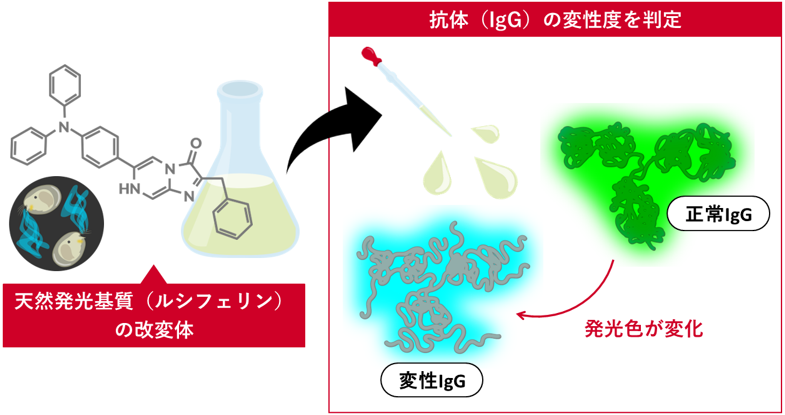
天然ルシフェリンの改変体は抗体の構造状態を反映して発光色を変化させる
国立研究開発法人 産業技術総合研究所(以下「産総研」という)健康医工学研究部門 西原諒 主任研究員、木原良樹 テクニカルスタッフ(研究当時)、栗田僚二 研究部門付は、慶應義塾大学理工学部 システムデザイン工学科 山本詠士 准教授、同大学院理工学研究科 平野秀典 特任准教授と共同で、治療や診断などに広く使用される抗体である免疫グロブリンG(IgG)と反応し、IgGの構造に応じて発光色を変える発光基質(ルシフェリン)を開発しました。
抗体は、生体内においてウイルスや細菌を認識し、排除する役割を担っており、診断薬や治療薬としても広く利用されています。しかし、抗体は製造・保存・使用の各過程で環境の影響を受けやすく、変性すると本来の機能が失われてしまいます。
本研究では、抗体の一種であるIgGがルシフェリンの発光反応を触媒する「擬似ルシフェラーゼ活性」を持つことを初めて発見しました。また、それを利用したIgGの変性検出技術を開発しました。この新規に設計、合成したルシフェリンの発光波長はIgGの構造に応じて変化するため、これを測定することでIgGの変性度を簡便かつ定量的に評価できます。本手法は従来の蛍光分析法よりも高い感度を持ち、開発したルシフェリンを混合するだけで3分以内に測定が完了するため、IgGに関連した抗体医薬品の品質管理や診断薬開発への貢献が期待できます。
なお、この技術の詳細は、2025年4月30日に「Analytical Chemistry」に掲載されます。
IgGなどの抗体は、生体内においてウイルスや細菌を認識・排除する重要な役割を担い、診断薬や治療薬としても広く利用されています。しかし、抗体の構造は保存条件や環境の影響を受けやすく、変性が進行すると本来の機能が損なわれます。抗体の変性は、製品の安全性と有効性に影響を与えるため、変性の進行状況をモニタリングする必要があります。現在、抗体の変性評価には、サイズ排除クロマトグラフィー(SEC)、動的光散乱(DLS)などの分析法が用いられています。しかし、これらの分析手法は専門的な知識と技術が必要です。そのため、抗体の変性度をより簡便かつ迅速に評価できる手法の開発が求められていました。
産総研は、ホタル発光酵素のような発光酵素機能を持たないと考えられてきた天然タンパク質でも、特異な化学構造を持つ発光基質に対して、擬似的な発光酵素活性を持つことを世界に先駆けて報告してきました*1。例えば、ウミホタルのルシフェリンが、新型コロナウイルスのスパイクタンパク質と特異的に反応して発光することを見いだしました(2024年1月17日 産総研プレス発表)。この発光反応はスパイクタンパク質でのみ観察されるため、ルシフェリンを混ぜるだけで、ヒト唾液中の新型コロナウイルスのスパイクタンパク質濃度を1分で測定することが可能です。またその精度は、酵素免疫測定法(ELISA)と同等であったことから、全く新しいタンパク質分析手法としての展開が期待されています。
今回、ウミホタルのルシフェリンに含まれるイミダゾピラジノン環に化学修飾を施した基質類縁体が、IgGと発光することを見いだしました。
本研究開発は、国立研究開発法人 科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「細胞の動的高次構造体」課題名:発光反応場を構成するペプチドプローブ開発(JPMJPR20EB)(2020~2024年度)、非膜性構造体内部における分子挙動の階層統合的理解(JPMJPR22EE)(2022~2025年度)、 独立行政法人 日本学術振興会(JSPS)科学研究費助成事業「若手研究」(22K14802)(2020~2024年度)、「基盤研究B」(22H02114)(2022~2024年度)による支援を受けています。
(1)IgGと発光反応を起こすルシフェリンの設計と合成
本研究では、IgGの変性に伴う構造変化に応じて発光波長が変化するルシフェリンの分子設計を行いました。ウミホタルをはじめとする多くの海洋性発光生物は、イミダゾピラジノン環を基本骨格とするルシフェリンを持ちます。このイミダゾピラジノン環は、対応する酵素の存在下で、酸化されることで発光反応を引き起こします。本研究では、IgGとの相互作用を促進し、IgGの構造変化に伴い発光波長の変化を引き起こすルシフェリンの開発を目指しました。そのために、ルシフェリンのイミダゾピラジノン環の炭素6位にトリフェニルアミン(TPA)基を導入しました(図1A)。TPA基は外部刺激(物理的な力や溶媒環境)に応じて分子内回転し(図1A)、HOMO-LUMOバンドギャップを変化させる特性を持ちます。従って、IgGの構造変化がルシフェリンのTPA基に作用することで、発光波長の変化が誘発されることを期待しました。実際に、合成したルシフェリンは免疫グロブリンの混合体であるポリクローナル抗体のIgGと発光反応を起こし(図1B)、正常なIgGでは緑色発光(最大発光波長539 nm)を示したのに対し、熱処理によって変性したIgGでは青色発光(最大発光波長509 nm)を示しました(図1C)。これは、IgGが発光反応を触媒する「擬似ルシフェラーゼ活性」を呈することを示した初めての例です。以前、ヒト由来タンパク質のヒト血清アルブミン(HSA)で発光する基質を“Human Luminophore 1 (HuLumino1)”と命名したことから*2、ヒト由来IgGで発光する新規ルシフェリンを“HuLumino2”と命名しました。
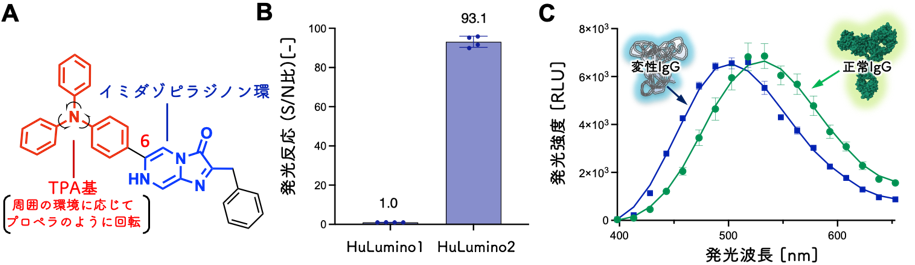
図1 (A)HuLumino2の化学構造 (B)ルシフェリンとポリクローナルIgGの発光反応の検証:HSA用ルシフェリンHuLumino1は反応しないが、IgG用に設計したルシフェリンHuLumino2は高い発光反応を示す。(C)HuLumino2と正常ポリクローナルIgGまたは変性ポリクローナルIgGの発光スペクトル:正常状態だと緑色に発光するが、変性状態になると青色に発光する。
※原論文の図を引用・改変したものを使用しています。
(2)HuLumino2結合サイトの予測
HuLumino2と全長体IgGと3種類の
IgGフラグメント(Fc, Fab, F(ab’)2)の発光強度を測定した結果、全長体IgGは他のフラグメントIgGと比べて約10倍高い発光強度を示しました(図2A)。この測定結果は、HuLumino2の発光反応に関与する主な触媒活性部位が、全長体のみが持つ
ヒンジ領域であることを示唆します。さらに、
分子動力学(MD)シミュレーションにより、IgGとHuLumino2の相互作用解析を実施した結果、HuLumino2はTPA基を介して、主にIgGのヒンジ領域に結合することが予測されました(図2B)。MDシミュレーションでは、HuLumino2がヒンジ領域の疎水性部分に結合し、特定のアミノ酸(Tyr306, Pro695, Pro697, Lys787)によって安定化される分子認識様式を予測することができました(図2B)。発光測定およびMDシミュレーションによって予測された発光活性部位のヒンジ領域は、すべての全長体IgGに保存される領域であるため、HuLumino2はさまざまな種類のIgGとも発光反応を起こす可能性が示唆されました。
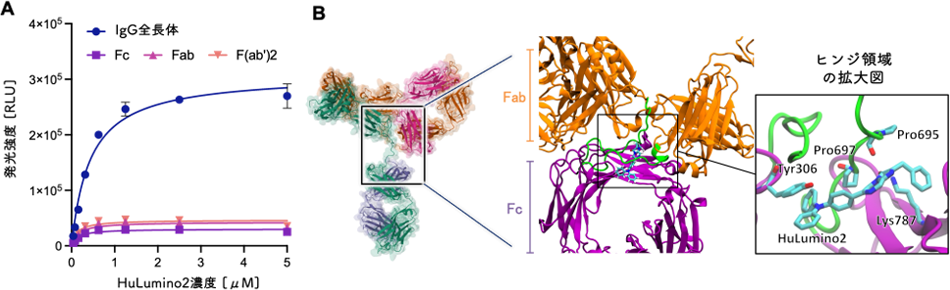
図2 (A)IgGの全長体とフラグメントの発光強度の比較 (B)MDシミュレーションで得られたルシフェリンとIgGの結合様式
※原論文の図を引用・改変したものを使用しています。
(3)モノクローナル抗体(mAb)医薬品の品質評価
均質な免疫グロブリンであるモノクローナル抗体(mAb)を利用した医薬品は、主にIgGを基に開発され、がん、骨粗しょう症などの幅広い疾病の医薬品として利用されています。IgGには四つのサブクラス(IgG1, IgG2, IgG3, IgG4)があり、それぞれ重鎖のアミノ酸配列、ヒンジ領域の特徴(長さ、ジスルフィド結合の数など)が異なります。mAb医薬品は、IgG1、IgG2および IgG4を基に開発されているため、これらのサブクラスを基にした医薬品を対象に本技術の適用性を評価しました。結果として、すべての医薬品において発光活性を確認できましたが、正常状態と変性状態でルシフェリンの発光波長の変化が認められたのは、IgG2のみでした。これは、ルシフェリンがIgG2特有のヒンジ領域の構造変化によってのみ発光波長を変化させたためと考えられます。その発光波長は、熱変性させたIgG2の増加に応じて、発光色を緑色から青色に変化させることを確認しました(図3A)。この波長変化幅の値は、変性IgG2の割合が20vol%に達するまで直線的に増加し、その検出限界(LOD)は1.8%であることを確認しました(図3B)。変性抗体の定量には、蛍光色素などを用いた蛍光検出法が利用される例もありますが、蛍光強度変化を測定する方法であるため、バックグラウンドシグナルの影響を受けやすいという課題がありました。本研究で開発した発光アッセイ法は、誤差の出やすい発光強度の変動ではなく、発光波長の変化を指標とするため、より信頼性の高い定量分析が可能になります。
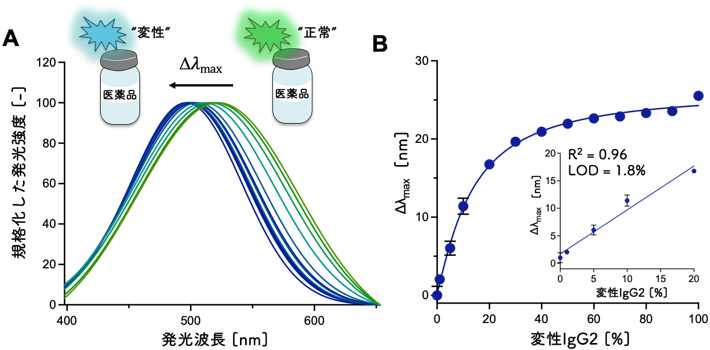
図3 (A)IgG2医薬品の変性に伴う発光波長の変化:各発光スペクトルの最大発光強度を100に規格化した。(B)変性IgG2含有率と最大発光波長変化幅の相関:正常IgG2の最大発光波長からの変化値をΔλmaxと表現した。
※原論文の図を引用・改変したものを使用しています。
以上の結果により、HuLumino2とIgGを混合するだけで、IgGの変性度を定量的に検知できる可能性を明らかにしました。今回開発した手法は、ルシフェリンと混ぜて発光色を読み取る簡単なプロセスでIgGの変性度を3分以内に検出できるため、SECやDLSなどの従来法よりも簡便かつ迅速な技術であり、IgGの品質を評価できる新たな手段として期待されます。
今後はルシフェリンの化学構造をより最適化することにより、IgG1やIgG4など他のmAb医薬品や診断薬の変性検出にも適用可能な発光分析技術を開発します。ルシフェリンを添加するだけで迅速に評価できるその簡便さから、本手法はハイスループット解析にも適用可能で、今後さまざまな抗体製品の品質管理や安定性試験への応用が期待できます。
掲載誌:Analytical Chemistry
論文タイトル:Discovery of Pseudo-Luciferase Activity in Immunoglobulin G (IgG) and its Application to the Detection of IgG Denaturation
著者:西原諒、木原良樹、山本詠士、平野秀典、栗田僚二
DOI:10.1021/acs.analchem.5c00646
*1:Nishihara et al, “Pseudo-Luciferase Activity of the SARS-CoV-2 Spike Protein for Cypridina Luciferin”, ACS Cent. Sci., 2024, 10, 283-290.
*2:Nishihara et al, “Coelenterazine Analogue with Human Serum Albumin-Specific Bioluminescence”, Bioconjugate Chem., 2020, 31, 2679-2684.