- 新型コロナウイルスのスパイクタンパク質がウミホタルの発光基質を発光させる機能を発見
- ウミホタルの発光基質はさまざまなタンパク質が共存する中、スパイクタンパク質で特異的に発光
- 新型コロナウイルスの簡便かつ迅速な検出法として期待
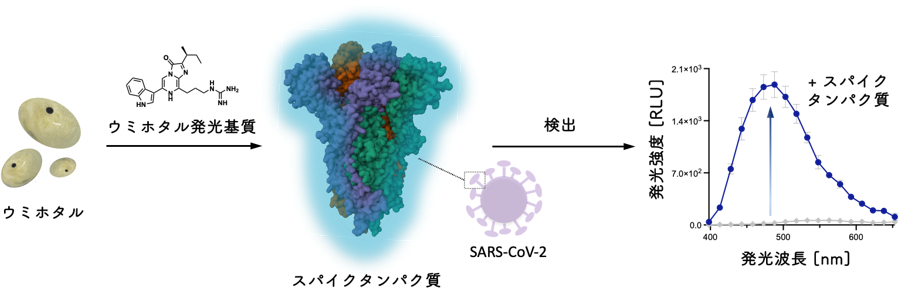
SARS-CoV-2のスパイクタンパク質自身の酵素的機能を利用した検出
国立研究開発法人 産業技術総合研究所(以下「産総研」という)健康医工学研究部門 西原 諒 主任研究員、木原 良樹 テクニカルスタッフ、栗田 僚二 研究グループ長、センシングシステム研究センター 芦葉 裕樹 主任研究員は、国立研究開発法人 理化学研究所(以下「理研」という)計算科学研究センター粒子系生物物理研究チーム 杉田 有治 チームリーダー(開拓研究本部杉田理論分子科学研究室 主任研究員、生命機能科学研究センター分子機能シミュレーション研究チーム チームリーダー)、開拓研究本部杉田理論分子科学研究室 ヒッシャム・M・ドカイニッシュ 特別研究員(研究当時)と共同で、新型コロナウイルス(SARS-CoV-2)表面の「スパイクタンパク質」が、ウミホタルの発光基質であるウミホタルルシフェリンを発光させる現象を発見しました。
この発見は、スパイクタンパク質の検出手法としても有望です。さまざまなタンパク質が共存する唾液試料中でも、ウミホタルルシフェリンは新型コロナウイルスのスパイクタンパク質だけと反応します。この現象を利用して、唾液にウミホタルルシフェリンを混ぜるだけで、スパイクタンパク質を測定時間1分ほどで検出できました。この方法は、従来のPCR法や抗原検査よりも簡便かつ迅速な新型コロナウイルスの検出技術として期待できます。
なお、この技術の詳細は、2024年1月17日(米国東部時間)に「ACS Central Science」に掲載されます。
新型コロナウイルス感染症の感染診断では、ウイルスに特徴的な遺伝子を増幅して検出する方法(PCR法)とウイルスタンパク質抗原を検出する方法(抗原検査法)が主に用いられています。PCR法は感度が高いことから確定診断に適しますが、検査に2時間程度かかるため、大量の検体を迅速に検査することが困難です。また、簡便な手法である抗原検査法でも10分以上の検査時間を要するため、これら従来技術よりも簡便で迅速なウイルス検出法が求められていました。
産総研は、発光酵素として知られていないタンパク質が、特異な化学構造を持つ発光基質を発光させることを世界に先駆けて報告してきました(Nishihara et al., Bioconjugate Chem., 2020, Analyst, 2021)。例えば、オワンクラゲにも含まれる発光基質セレンテラジンの化学構造を改変した類似の化合物が、ヒト血清アルブミン(HSA)により発光することを見いだしています。この発光反応はHSAでのみ観察されるため、基質を混ぜるだけで、前処理をしていないヒト血清中のHSA濃度を1分程度で検出することが可能です。さらに、その精度は酵素免疫測定法(ELISA)と同等であったことから、原理的にも全く新しいタンパク質分析手法としての展開が期待できます。しかし、HSA以外のタンパク質にも同様に擬似発光酵素としての活性があり、さらにその活性が分析に利用できるかは検証されていませんでした。そこで今回、この手法の新型コロナウイルスのスパイクタンパク質への適用可能性を検証しました。
なお、本研究開発は、国立研究開発法人 科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「細胞の動的高次構造体(2020~2023年度)」、独立行政法人 日本学術振興会(JSPS)科学研究費助成事業「若手研究(2022~2024年度)」「基盤研究B(2022~2024年度)」、国立研究開発法人 新エネルギー・産業技術総合開発機構(NEDO)「マテリアル革新技術先導研究プログラム(2021年度)」「IoT社会実現のための革新的センシング技術開発(2019〜2022年度)」による支援を受けています。
(1)スパイクタンパク質と発光反応を起こす発光基質の選定
SARS-CoV-2スパイクタンパク質の擬似発光活性を見いだすために、単量体スパイクタンパク質と化学構造の異なる36種類の発光基質の組み合わせによる発光測定を行いました(図1A-C)。その結果、スパイクタンパク質は、ウミホタルに含まれる発光基質ウミホタルルシフェリンのみと発光反応を起こすことを見いだしました。スパイクタンパク質は、S1とS2タンパク質から構成され、S1タンパク質には被感染細胞の受容体と結合するレセプター結合ドメイン(RBD)が含まれます。これらスパイクタンパク質の断片タンパク質(S1、S2、RBDに分解したタンパク質)とウミホタルルシフェリンの発光測定により、ウミホタルルシフェリンはRBD領域を除いたS1タンパク質およびS2タンパク質で酵素反応が生じることも判明しました(図1D)。またS1とS2タンパク質を含む全長スパイクタンパク質(単量体)は、断片タンパク質よりも高い発光強度と基質に対する親和性を持ちます(図1D)。すなわち、ウミホタルルシフェリンは、S1とS2タンパク質が組み合わさることで生じる、タンパク質ドメインの界面で効率的に発光すると考えられます。
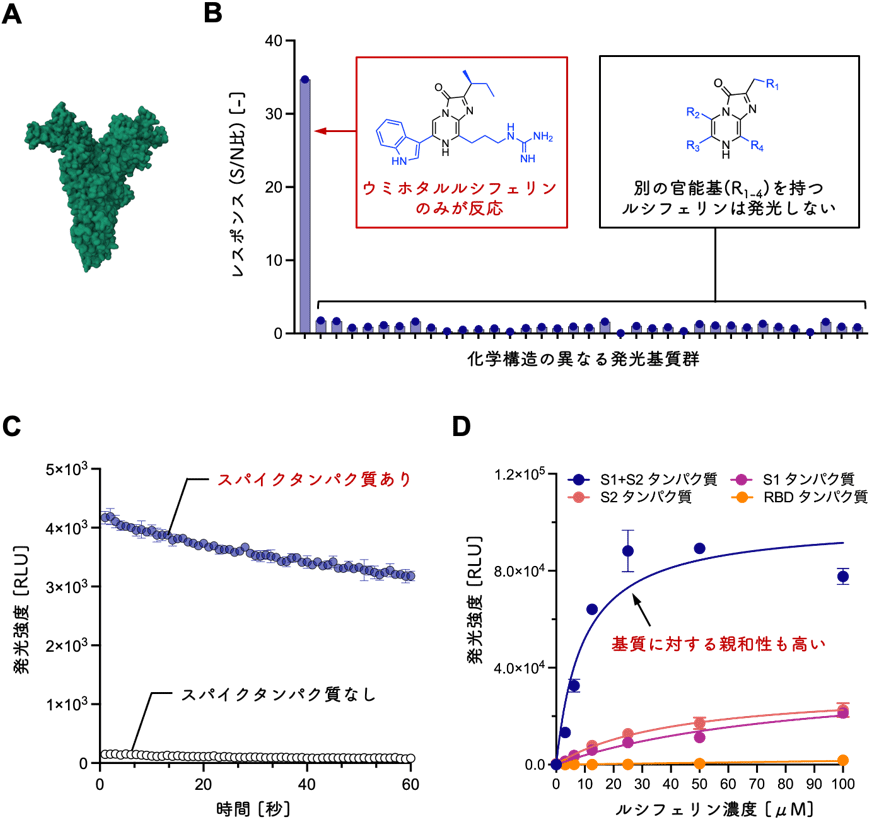
図1 (A)SARS-CoV-2スパイクタンパク質(単量体)構造 [PDB code: 7FG7] (B)36種類の発光基質とスパイクタンパク質(単量体)の発光レスポンス検証 (C)ウミホタルルシフェリンとスパイクタンパク質(単量体)の発光強度の経時変化 (D)スパイクタンパク質(単量体)とその断片タンパク質の発光強度の比較:S1とS2が組み合わさった構造で、発光強度が上昇し、基質に対する親和性も高くなる。
※原論文「Pseudo-Luciferase Activity of the SARS-CoV-2 Spike Protein for
Cypridina Luciferin」の図を引用・改変したものを使用しています。
(2)三量体スパイクタンパク質を用いた発光測定とウミホタルルシフェリン結合サイトの予測
新型コロナウイルス表面のスパイクタンパク質は、三量体として存在します。三量体の場合、ウミホタルルシフェリンに対して単量体よりも発光強度が高いことを確認しました(図2A)。これは発光反応が起こる場(タンパク質ドメインの界面)の数が、単量体より三量体の方が多いことに起因すると考えられます。実際にドッキングシミュレーションによりウミホタルルシフェリン結合サイトを予測すると、ウミホタルルシフェリンは三量体スパイクタンパク質ドメインの界面に結合する傾向にあることが分かりました(図2B)。
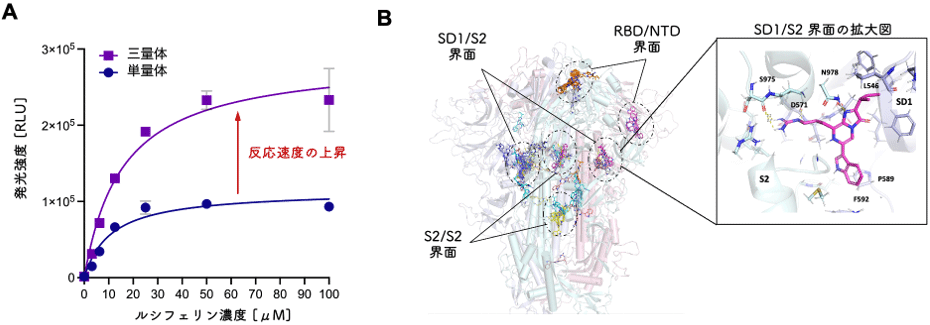
図2 (A) SARS-CoV-2スパイクタンパク質の単量体と三量体の発光強度の比較 (B)ウミホタルルシフェリンと三量体スパイクタンパク質[PDB code: 6VXX]のドッキングシミュレーション結果:ウミホタルルシフェリンが結合し得る場所はいずれも、タンパク質ドメイン間の界面。全ての予測結合サイトが発光反応に関与するかは現状不明。
※原論文「Pseudo-Luciferase Activity of the SARS-CoV-2 Spike Protein for
Cypridina Luciferin」の図を引用・改変したものを使用しています。
(3)擬似発光酵素機能を利用したスパイクタンパク質の定量分析
ウミホタルルシフェリンは、アミラーゼをはじめとした、唾液に含まれるタンパク質には反応しません(図3A)。またウミホタルルシフェリンの発光の強さは、スパイクタンパク質の量に依存します(図3B)。そこで、未処理の唾液を検体とするスパイクタンパク質の添加回収試験を実施した結果、ウミホタルルシフェリン添加後、1分間の発光強度を測定するだけで、唾液中のスパイクタンパク質を定量することに成功しました。その精度はELISAと同等でした(図3C)。
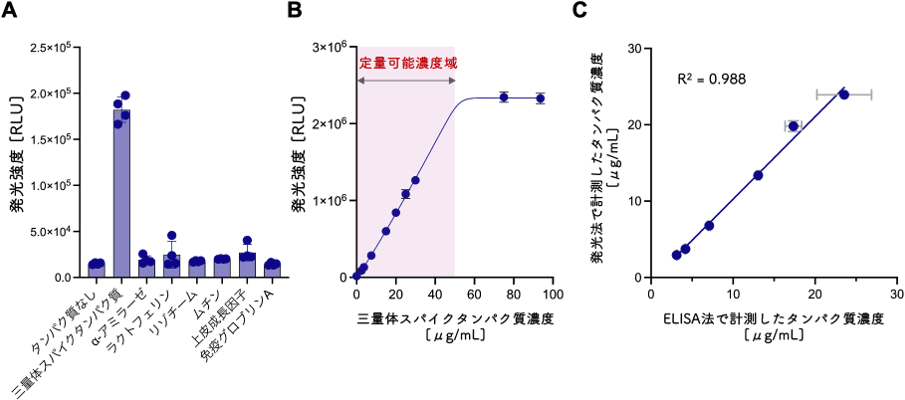
図3 (A)唾液に含まれるタンパク質とウミホタルルシフェリンの反応性試験 (B)ウミホタルルシフェリン発光強度のスパイクタンパク質濃度依存性(C)唾液を検体としたスパイクタンパク質の添加回収試験:ELISA法との比較結果。
今回、新たに見いだしたウイルスタンパク質の擬似発光酵素機能を利用したタンパク質分析手法は、従来技術よりも簡便かつ迅速にウイルスタンパク質を定量でき、今後新たなウイルス計測技術としての活用が期待されます。
今後はルシフェリンの化学構造を最適化して、より高感度なウイルス関連タンパク質の計測技術を開発します。また、ウイルスの診断薬として実用化を目指します。
掲載誌:ACS Central Science
論文タイトル:Pseudo-Luciferase Activity of the SARS-CoV-2 Spike Protein for Cypridina Luciferin
著者:西原諒、ヒッシャム・M・ドカイニッシュ、木原良樹、芦葉裕樹、杉田有治、栗田僚二
DOI:10.1021/acscentsci.3c00887