国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)省エネルギー研究部門【研究部門長 宗像 鉄雄】エネルギー界面技術研究グループ 周 豪慎 首席研究員(兼)研究グループ長(兼)東京大学先端電池材料社会連携講座(以下「連携講座」という)特任教授は、李 福軍 産総研特別研究員(兼)連携講座研究員、筑波大学大学院博士課程 呉 世超、李 得 元産総研特別研究員、張 涛 元産総研特別研究員、東京大学【総長 五神 真】大学院工学系研究科 山田 淳夫 教授(兼)連携講座特任教授、南京大学 何 平 准教授と共同で、水を触媒としてわずかに添加した有機電解液DMSOを用いると、リチウム-空気電池の空気極の過電圧を大幅に低減できることを示した。
リチウム-空気電池は、空気中の酸素を電気化学反応に利用するため、理論的には現状のリチウムイオン電池よりはるかに高い重量エネルギー密度を持つことが期待されている。一方で、リチウム-空気電池には様々な問題点があり、すぐに実用化につながるような状況にはない。大きな問題の一つに、リチウムと酸素の電気化学反応が理想的には進行しないため、放電時に得られる電圧と充電に必要な電圧の差が約1.0 Vと大きくなり、エネルギー効率が悪くなるという点がある。
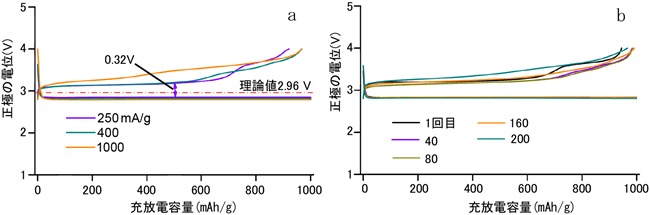
今回、空気極の充電・放電の反応機構の解明と過電圧の削減を目的とする基礎研究において、空気極に炭素・ルテニウム・二酸化マンガンを用い、有機電解液DMSOにわずかの水(=約100 ppm)を加えると、充電過電圧が約0.21 Vまで大幅に縮小し、放電時に得られる電圧と充電に必要な電圧の差がわずか0.32 Vであることを確かめた。
なお、この成果は、平成27年7月24日18:00(日本時間)に英国の国際科学学術誌Nature Communicationsのオンライン版に掲載される。
 |
|
開発したリチウム-空気電池用空気極のレート特性(左)と電流密度500 mA/g(=0.25 mA/cm2)での200回の充放電サイクル特性(右) |
近年、エネルギー・環境問題を背景として、電気自動車の普及が進んでいる。現在、電気自動車にはリチウムイオン電池が搭載されているが、より長距離を走行できる高性能蓄電池の開発が求められている。そこで、理論的には現在のリチウムイオン電池の約5~8倍の重量エネルギー密度をもつリチウム-空気電池がポストリチウムイオン電池として注目されている。しかしながら、空気極での充電・放電の反応機構がよく分かっていないこと、充電時の過電圧が1.0 V以上の大きな値になってしまうこと、充放電サイクル特性が悪いことなどの問題がある。
産総研ではこれまで、次世代リチウムイオン電池の実用化を目指して、電極材料をナノ構造化することで大出力化が期待できることを示してきた(2008年8月27日 産総研プレス発表)。また、電気自動車用として大幅な重量エネルギー密度の向上が期待される新型リチウム-空気電池(2009年2月24日 産総研プレス発表、2012年11月5日 産総研主な研究成果)の研究開発を行ってきた。現在、次世代蓄電池として、リチウム硫黄電池、ナトリウムイオン電池の研究と共に、リチウム-空気電池の研究開発を続けている。
リチウム-空気電池は空気中の酸素(O2)を電気化学反応に利用している。放電する場合には、外部回路からの電子と、電解液中のリチウムイオン(Li+)が、空気極中に拡散してきた酸素と還元反応を起こして、過酸化リチウム(Li2O2)になり、充電する場合には、逆にLi2O2が酸素発生反応を伴って分解し、リチウムイオンと酸素になるのが理想的な反応である。ところが、空気極でのLi2O2酸素発生反応の過電圧が1.0 V以上の大きな値になってしまい、その高い過電圧によって空気極に用いられているカーボンや触媒なども腐食されてしまう。そのため、腐食対策として、カーボンフリーの空気極、過電圧対策として、ヨウ素イオンなどの利用が盛んに研究されている。
今回、これまで非水系リチウム-空気電池では、避けられていた水に注目した。今回の測定システムでは、空気極の過電圧を評価するために、負極にリン酸鉄リチウム(LiFePO4)を用い、DMSOにわずかな水(約100 ppm)を加えて有機電解液とし、空気極の触媒には、炭素とルテニウム(Ru)と二酸化マンガン(MnO2)を用いた。この構成の電池では、空気極の上に放電で生成したLi2O2がH2Oと反応して、固体状の水酸化リチウム(LiOH)と過酸化水素(H2O2)になる(Li2O2 + 2H2O = 2LiOH + H2O2)。LiOHは低い電位で、酸素発生反応により分解され、Li+、O2とH2Oになり、また、H2O2もMnO2触媒による酸化還元反応で、O2とH2Oになる。これらの反応で、H2Oは、中間体LiOHを経由して消耗せずに循環して触媒の役割を果たしている。今回の空気極により、空気極のカーボン+Ru+MnO2の重さを基準にした電流密度250 mA/gで、充電と放電の過電圧がそれぞれ、0.21 Vと0.11 Vに低減され、放電時に得られる電圧と充電に必要な電圧の差がわずか0.32 Vとなった。更に、電流密度が500 mA/gと1000 mA/gの場合も、充電の過電圧が大幅に削減された。また、放電容量1000 mAh/gに規定した充放電サイクル試験では、安定した200回の充放電サイクル特性が得られた。
今後は、リチウム-空気電池の空気極について、構成の最適化、作動環境の検討などを行い、更にDMSO以外の電解液に展開し、リチウム-空気電池の基礎研究を積み重ねて、優れた性能を示すリチウム-空気電池の開発を目指す。