国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)省エネルギー研究部門【研究部門長 宗像 鉄雄】周 豪慎 首席研究員 兼 南京大学講座教授 兼 筑波大学連携大学院教授とエネルギー界面技術グループ 王 雅蓉 博士は三菱自動車工業株式会社と共同で、世界で初めて正極側の活物質に共融系液体を利用した二次電池を開発した。
二種類の固体物質を共融点組成で混合すると、凝固する温度が大幅に低下する。レアメタルを含まない安価な三塩化鉄六水和物 (FeCl3・6H2O)と尿素(CO(NH2)2)とを共融点組成で混合して液体とし、これを正極側の活物質として用いた。正極側の電解液を別途必要とせず、また固体で問題になる構造劣化が生じない点が、電池を構成する上での大きな利点となる。
金属リチウムの負極と組み合わせると、電圧が約3.4 V、正極側の体積容量(共融系液体の体積当たりの容量)141 mAh/cm3の二次電池として動作した。
なお、本研究成果は、2016年6月3日に英国の学術誌「Energy & Environmental Science」のオンライン版に掲載された。
 |
|
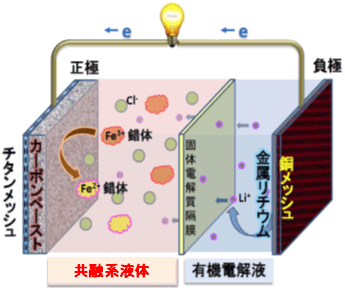
図1 金属リチウム負極と組み合わせた共融系二次電池(図は放電している状況) |
近年、環境・エネルギー問題を背景として、携帯電気製品、電気自動車、電力貯蔵などのさまざまな分野で二次電池への要求が高まっている。これらの電源には主にリチウムイオン電池が使用されているが、それを構成する電解液には揮発性の有機溶媒とリチウム塩、また正極にはコバルトやニッケルなどのレアメタルと呼ばれる高価な遷移金属を含む酸化物固体が使われている。これらの材料、特に高価な遷移金属などは回収・精製して再利用できるが、コストや環境負荷といった課題がある。また正極の固体は、繰り返し使用すると充放電の際のリチウムイオンの出入りにより、徐々に構造が壊れていくという問題点もある。
産総研は次世代リチウムイオン電池の実用化を目指しており、電極材料のナノ構造化により大出力化が期待できることを示してきた(2008年8月27日 産総研プレス発表)。また、金属リチウムを負極に、酸素を正極に用いた、ハイブリッド系リチウム-空気電池(2009年2月24日 産総研プレス発表、2012年11月5日 産総研主な研究成果)の研究開発を行ってきた。現在、他の次世代の二次電池として、非水系リチウム-空気電池、リチウム-硫黄電池、ナトリウムイオン電池と共に、安価で環境に優しい共融系液体を用いた電池(共融系電池と略す)の研究開発を進めている。
正極の活物質である塩化鉄水和物(FeCl3・6H2O)の結晶粒子に、尿素(CO(NH2)2)の固体粉末を混合して共融系液体とした。これらの物質は常温ではそれぞれ固体であるが、共融点組成で混合すると凝固点が大幅に低下して約-7℃まで固化しなくなる。正極側にこの共融系液体を用い、負極側にはリチウムイオン電池では一般的な金属リチウムと有機系の電解液を用いて共融系電池を試作した(図1)。なお、正極側の共融系液体は活物質と電解液の二つの役割を担っている。二種類の電解質液体を隔てるため、リチウムイオン伝導性の固体電解質(LISICON膜)の隔膜を用いた。この共融系電池の理論的な特性は、電圧が約3.4 V、正極側の容量が共融系液体FeCl3・6H2O-尿素の重量当たりで89 mAh/g、体積当たりで145 mAh/cm3である。実際に作製した電池で、25℃と40℃での充放電特性を測定したところ、初期放電電圧が約3.4 V、正極側の容量が40℃では141 mAh/cm3で、今回用いた共融系液体が正極の活物質としてほぼ理論値に近い理想的な動作をしていた。
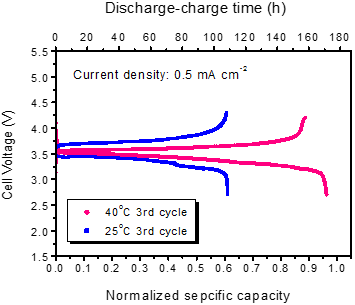
具体的な電池特性の一例として3回目(3サイクル目)の充放電特性を図2に示した。図2の縦軸は充放電時の電池の電圧である。電池に用いられる活物質の量から、電池容量の理論値が計算されるので、その値を1に規格化して表示したのが横軸の下側である。この充放電特性の測定は、0.5 mA/cm2という一定の電流密度で行っているため、充放電の電流量と要した時間が比例関係にあり、その時間を横軸の上側に示してある。図中の二つの曲線のうち、下側が放電時のもの、上側が充電時のものである。赤色が40℃、青色が25℃の場合で、温度が高い場合は理論容量の97 %まで放電電流量が得られたが、温度の低い場合は60 %にとどまり、この改善が今後の課題である。
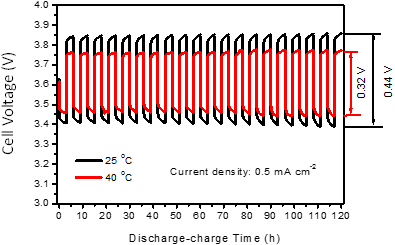
図2と同じ0.5 mA/cm2の一定電流密度にて、3時間放電と3時間充電とを繰り返し行った充放電試験の最初の20サイクルの様子を図3に示した。縦軸は充放電時の電池の電圧、横軸は時間経過を示している。黒線は25℃、赤線が40℃での結果である。電池容量に比べて、この条件の充放電量は部分的であり、また繰り返しのサイクル数も20回と少ないものの、ほぼ変化のない繰り返し特性が認められる。温度が低い25℃の場合の充電時(上側)と放電時(下側)の電圧差(0.44 V)が40℃(0.32 V)より大きくなっており、図2に示した場合と同様、この電池は温度の低い側に課題があることが見て取れる。ただし、試作段階の電池としては繰り返しの充放電動作が安定しており、正極の活物質が液体であることの利点が現れているものと期待される。
 |
|
図2 25℃と40℃で測定した3サイクル目の充放電特性 |
 |
|
図3 25℃と40℃にて3時間ずつ充放電で測定した20サイクルの充放電曲線 |
今後は、負極側にも共融系液体を用いた全共融系型二次電池を含め、優れた性能を示す実用的な共融系電池の開発を推進する。
国立研究開発法人 産業技術総合研究所
省エネルギー研究部門
首席研究員 周 豪慎 E-mail:hs.zhou*aist.go.jp(*を@に変更して送信下さい。)
省エネルギー研究部門 エネルギー界面技術グループ
テクニカルスタッフ 王 雅蓉
省エネルギー研究部門
研究部門長 宗像 鉄雄 E-mail:t.munakata*aist.go.jp(*を@に変更して送信下さい。)