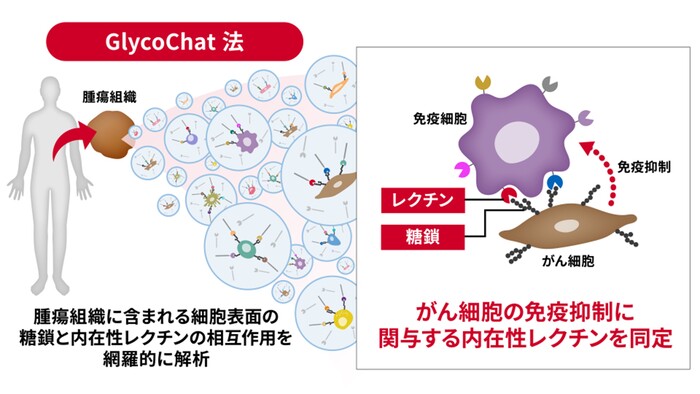
- がんの腫瘍組織内における糖鎖-レクチン相互作用を網羅的に探索するGlycoChat法を開発
- 開発手法を用いて、マクロファージに発現する内在性レクチンのうち、膵がん細胞の糖鎖と相互作用して免疫抑制に関与するレクチンを同定
- 糖鎖に関連する免疫チェックポイント分子の同定が可能となり、それを標的とした新たな阻害剤の開発に向けた基盤を提供
※原論文の図を引用・改変したものを使用しています。
国立研究開発法人産業技術総合研究所(以下「産総研」という)細胞分子工学研究部門 舘野 浩章 研究グループ付らと、筑波大学医学医療系 小田 竜也 教授らの研究チームは、がんの腫瘍組織内における糖鎖-レクチン相互作用を網羅的に探索する新手法「GlycoChat法」を開発しました。この手法を用いて、がん細胞への免疫応答を抑制する働きをもつマクロファージと膵がん細胞との相互作用を糖鎖レベルで解明しました。
近年、がん細胞表面のタンパク質などに結合した糖鎖が、免疫細胞上に発現するレクチンと結合することで、がん細胞が免疫回避する免疫チェックポイントとして機能することが分かってきました。この糖鎖-レクチン相互作用による免疫制御機構は、膵がんをはじめとする難治性がんに対する新たな治療標的となる可能性があります。それを実現するためには、がん腫瘍組織内における多種の細胞の糖鎖と免疫細胞に発現するレクチンとの相互作用の強さを調べ、免疫抑制に関与している糖鎖とレクチンの組み合わせを同定しなければなりません。しかし、それには多大な労力と時間が必要です。
今回、腫瘍組織内における糖鎖-レクチン相互作用を網羅的に探索する新手法GlycoChat法を開発しました。また、本手法を用いて膵がん患者の腫瘍組織を解析した結果、マクロファージに発現し、膵がん細胞の糖鎖と相互作用して免疫抑制に関与する内在性レクチンの同定に成功しました。本技術により、膵がんをはじめとする難治性がんにおける糖鎖免疫チェックポイント分子の同定を可能とし、それを標的とした新規機序による阻害剤の開発に向けた基盤の提供が可能になります。
なお、この研究成果の詳細は、2026年1月14日※)に「Advanced Science」に掲載されます。
※)論文の掲載日を訂正しました(2026年1月15日)。
ヒトをはじめとする動物は、免疫によって異物の侵入やがん細胞の増殖から生体を守っています。免疫には正常な自己組織に反応しないよう免疫チェックポイントという制御機能が備わっていますが、一部のがん細胞はこれを「悪用」し、免疫細胞に攻撃対象ではないと「誤認」させることで増殖します。がん治療に用いられている免疫チェックポイント阻害剤は、がん細胞による免疫チェックポイントの悪用を阻止することで、免疫細胞にがん細胞を攻撃させる薬です。この薬は、ある種のがんに対して増殖を抑制する効果を発揮しますが、免疫細胞が過剰に活性化し自己組織を攻撃することによる副反応への注意が必要です。
近年、がん細胞表面の糖鎖が、免疫細胞表面に発現するレクチンと相互作用することで免疫細胞の働きを抑制し、がんの免疫回避に関与する新たな免疫チェックポイントとして機能していることが明らかになってきました。これらの糖鎖-レクチン相互作用は、がん細胞と免疫細胞の間で働くタンパク質同士の結合による、従来の免疫チェックポイントとは異なる仕組みで免疫を制御すると考えられています。このような免疫制御機構は、膵がんをはじめとする難治性癌において、既存の免疫チェックポイント阻害剤による治療効果が限定的であることから、難治性がんに対する新たな治療標的となる可能性が期待されています。
産総研はこれまで、1細胞ごとの糖鎖と遺伝子の発現情報を取得する、「1細胞糖鎖・RNAシーケンス(scGR-seq)法」の開発に成功しています(2021年7月27日産総研プレス発表、2024年1月15日産総研プレス発表)。しかし従来のscGR-seq法では、組織内における糖鎖と内在性レクチンの分子レベルでの相互作用を直接観察することはできないため、腫瘍組織におけるがん細胞の糖鎖が相互作用する内在性レクチンの同定はできませんでした。今回、DNAバーコードで標識した内在性レクチンをscGR-seqに利用し、腫瘍組織における糖鎖-レクチン相互作用を包括的に解析する手法の開発に取り組みました。本手法を用いて膵がん患者の腫瘍組織を解析することで、膵がん細胞の糖鎖がマクロファージ上に発現するCLEC10AとSIGLEC3と呼ばれる内在性レクチンと相互作用することで、マクロファージの免疫抑制を誘導することを明らかにしました。
なお、本研究はCOCKPI-T Funding、科学研究費基盤研究B、次世代がん医療加速化研究事業、2025年度つくば産学連携強化プロジェクトの支援を受けています。
膵がん患者から外科的に切除された腫瘍組織を、単一細胞懸濁液に分離、scGR-seq法で解析し、個々の細胞に結合したレクチンの種類と相対分子数(糖鎖発現データ)、およびmRNA(遺伝子発現データ)を次世代シーケンサーで解析しました。最終的に5人の患者検体から合計54,634個の細胞の糖鎖と遺伝子の発現データを取得しました。遺伝子発現データから、腫瘍組織中には、がん細胞、上皮細胞、T細胞(ナイーブCD4+T細胞、エフェクター/メモリーCD4+T細胞、エフェクター/メモリーCD8+T細胞、疲弊CD8+T細胞)、マクロファージ(M1TAM, M2TAM)、骨髄由来抑制細胞(MDSC)、樹状細胞(cDC2、pDC)、B細胞、肥満細胞、血管内皮細胞、内分泌細胞、がん関連線維芽細胞(myCAF、iCAF)など、計19種の異なる細胞型が同定されました。遺伝子発現パターンから、膵がん細胞はさらに「古典型」、「中間型」、「基底様型」の3種のサブタイプに分類されました。レクチンの1細胞ごとの反応パターン(糖鎖プロファイルを表す)を図1に示しました。赤は高い反応性、青は低い反応性を示します。がん細胞はある特定のレクチン(rBC2LCNなど)との結合が検出された一方、非がん細胞はより広範なレクチンに対する反応性を示し、がん細胞に特徴的な異常糖鎖パターンを明らかにしました。がん細胞においては、古典型から中間型、基底様型への上皮間葉転換(EMT)過程で糖鎖発現パターンが変化することを明らかにしました。そして、古典型膵がんと基底様型膵がん、それぞれを特異的に検出できる特定のレクチンを同定しました。
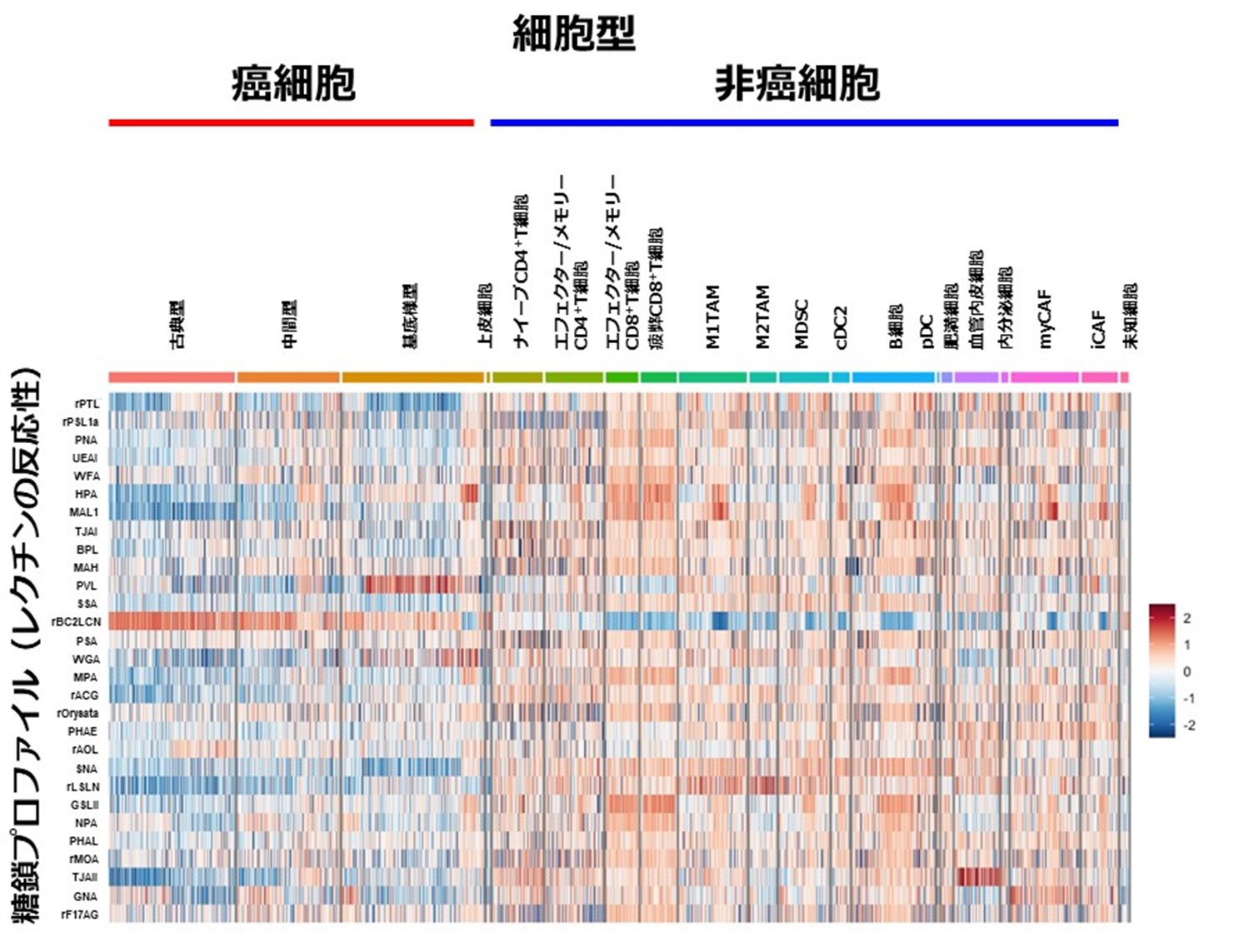
図1 膵がん腫瘍組織に含まれる1細胞ごとの糖鎖プロファイル
29種類のレクチンの各細胞への反応性を示したヒートマップ。赤色は高い反応性、青色は低い反応性を示す。
※原論文の図を引用・改変したものを使用しています。
がん細胞の表面糖鎖は、免疫細胞が発現する多様な内在性レクチンと相互作用し、腫瘍微小環境(TME)内における抗腫瘍免疫応答を調節します。がん細胞の糖鎖は複数の内在性レクチンと相互作用する可能性がありますが、これらの相互作用を包括的かつ単一細胞レベルで解析する技術は存在しませんでした。この課題を解決するため、我々はTME内の糖鎖-内在性レクチンネットワークをマッピングするプラットフォーム「GlycoChat」を開発しました。GlycoChatは3段階の工程で構成されます:(1) 内在性レクチンを組み込んだscGR-seq解析、(2) がんサブタイプと免疫細胞間の相互作用強度の推定、(3) がんサブタイプとの相互作用可能性に基づく内在性レクチンの順位付け。具体的には、内在性レクチンの膵がんサブタイプへの結合強度、内在性レクチン遺伝子の免疫細胞における発現量と発現特異性データを用いて、膵がんサブタイプごとに結合する内在性レクチンを順位付けし、膵がん細胞と相互作用する可能性を有する内在性レクチン候補を同定しました。上記のように、各膵がんサブタイプは特徴的な糖鎖プロファイルを示すことから、サブタイプごとに相互作用する内在性レクチンの解析を検討しました。これらの内在性レクチンのうち、浸潤性が強く、予後不良のサブタイプである基底様型膵がん細胞と相互作用する腫瘍関連マクロファージ(TAM)に発現するCLEC10AとSIGLEC3を、本研究のさらなる解析のターゲットとして選択しました。
がん細胞と、マクロファージに発現するCLEC10AもしくはSIGLEC3の相互作用の機能的意義を解析するために、膵がん細胞と、CLEC10A発現マクロファージもしくはSIGLEC3発現マクロファージを共培養しました。その後、CLEC10AおよびSIGLEC3の膵がん細胞への結合性をフローサイトメトリーで評価しました。その結果、CLEC10AおよびSIGLEC3の膵がん細胞への結合性が顕著に増強されることがわかりました。このことは、膵がん細胞が細胞表面糖鎖を変化させ、CLEC10AおよびSIGLEC3を介したマクロファージとの相互作用を促進させていることを示しています。
がん細胞はマクロファージに働きかけて免疫抑制型のM2マクロファージへの分極を促し、その結果として腫瘍に有利な免疫抑制環境を形成することが知られています。そこで、膵がん細胞とマクロファージ変異細胞の共培養系を用いて、膵がん細胞のマクロファージに対するCLEC10AとSIGLEC3を介した免疫抑制機能を解析しました。具体的には、CLEC10Aのみ発現、SIGLEC3のみ発現、両レクチン発現、および両レクチン非発現のマクロファージ細胞を作製し、膵がん細胞と共培養しました。そして共培養後のマクロファージの機能を、免疫抑制型のM2マクロファージの表面マーカーであるCD163とCD206の発現をフローサイトメトリーで評価しました。その結果、CLEC10AもしくはSIGLEC3を発現したマクロファージでは、膵がん細胞との共培養後、CD163とCD206の発現が増加することがわかりました。このことは、膵がん細胞は、CLEC10AもしくはSIGLEC3を介して、マクロファージを免疫抑制型に誘導することを示しています。さらに、CLEC10AおよびSIGLEC3は、マクロファージのがん細胞に対する貪食能を抑制することも明らかにしました。本知見は、CLEC10AとSIGLEC3がマクロファージの免疫抑制を誘導することで、免疫チェックポイント分子として機能する可能性を示しています。
今後は、CLEC10AやSIGLEC3を標的とする免疫チェックポイント阻害剤の開発を目指します。さらに、今回新たに確立した GlycoChat法を活用し、さまざまな難治性がんにおける新規糖鎖免疫チェックポイント分子の同定と、それに対する阻害剤の開発を推進します。加えて、GlycoChatデータを基盤として、各患者における免疫抑制を誘導する糖鎖ベースの免疫チェックポイント分子を予測することで、患者ごとに最適な免疫チェックポイント阻害剤を選択し、個別化治療方針の策定を可能とする技術の確立を目指します。
掲載誌:Advanced Science
タイトル:GlycoChat uncovers glycan-lectin circuits in the tumor microenvironment of pancreatic cancer
著者名:Anh Dinh Xuan Tuan, Sunanda Keisham, Arun Burramsetty, Lalhaba Oinam, Koichiro Kumano, Akihiro Kuno, Osamu Shimomura, Tatsuya Oda, Hiroaki Tateno (CA)
DOI:10.1002/advs.202514735