- 糖鎖と遺伝子の発現情報を同時に解析できる技術(scGR-seq法)によって、iPS細胞由来の神経細胞集団には、目的外細胞が混在していることを明らかに
- 目的外細胞を除去するため、それを標識可能な糖鎖マーカーの開発に成功
- 再生医療における細胞の品質管理や分離技術の高度化に貢献
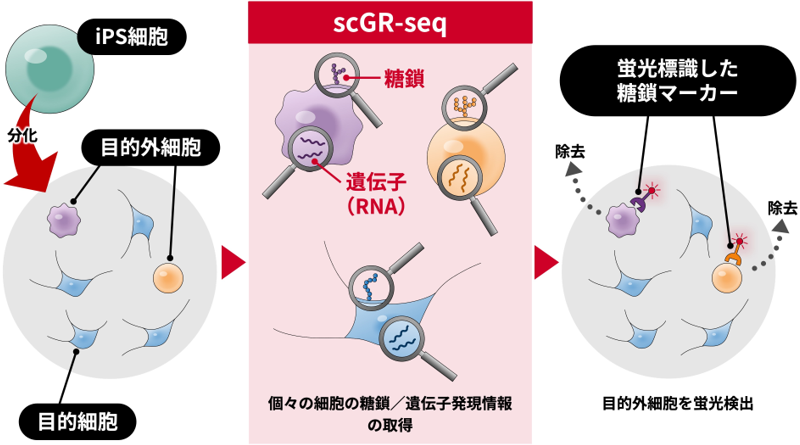
scGR-seq法によるiPS細胞由来分化細胞の糖鎖マーカー開発
国立研究開発法人 産業技術総合研究所(以下「産総研」という)細胞分子工学研究部門 小高陽樹 主任研究員、舘野浩章 研究グループ付は、iPS細胞から分化させて得られた神経細胞集団の糖鎖と遺伝子発現情報を詳細に解析し、その多様性と高発現する糖鎖抗原の特徴を見いだしました。また、その中から目的外細胞を標識できる糖鎖マーカーの同定に成功しました。
再生医療に利用するためにiPS細胞から分化させて得られた細胞集団には、目的とする細胞以外にもさまざまな「目的外細胞」が含まれています。これらの細胞は、治療効果や安全性に影響を及ぼす可能性があるため識別して除去する必要があります。目的外細胞を除去するためには、細胞表面に存在するタンパク質や糖鎖など、細胞の種類や状態を識別できるマーカーが有用です。しかし、目的細胞の種類や分化誘導方法によって混入する目的外細胞の種類は異なるため、すべてに共通するマーカーを作ることは困難です。このため、それぞれの細胞製造プロセスに応じて、目的外細胞の種類を調べそのマーカーを個別に見つける技術が求められていました。
今回、iPS細胞から分化誘導された神経細胞集団の糖鎖と遺伝子の発現情報を、産総研が過去に開発した、1細胞ごとに糖鎖と遺伝子の発現情報を同時に解析できる技術「単一細胞糖鎖・RNAシーケンス法(以下、「scGR-seq法」という)」を用いて詳細に解析しました。その結果、神経細胞集団に含まれる目的外細胞の細胞種と同細胞集団を標識可能な糖鎖マーカーを同定することに成功しました。本成果は、iPS細胞由来の細胞の品質管理や分離技術の高度化に貢献するものであり、再生医療の安全性と有効性の向上に寄与することが期待されます。
なお、この技術の詳細は、2025年9月4日(米国東部時間)に「Stem Cell Reports」に掲載されます。
iPS細胞は、さまざまな細胞に分化できる特別な細胞であり、再生医療や新しい薬の開発に役立つと期待されています。例えば、病気やけがで失われた細胞を補ったり、患者の細胞を使って薬の効果を調べたりすることが可能になります。しかし、iPS細胞から分化誘導して作られた細胞の中には、治療に使いたい細胞だけでなく、未分化の細胞や意図しない系統に分化した細胞などが混在しています。これらの目的外細胞が体内に入ると、思わぬ副作用や安全性の問題を引き起こすおそれがあります。そのため、iPS細胞を安心して医療に使用するには、目的外細胞を取り除く必要があります。
目的外細胞を識別して取り除くためには、細胞表面に存在するタンパク質や糖鎖など、細胞の種類や状態を見分けるための目印となるマーカーが重要です。特に、生体の細胞内外のタンパク質や脂質についている糖鎖は、細胞の種類や状態によって変化するため、マーカーとして広く利用されています。目的外細胞に特有のマーカーを同定できれば、フローサイトメトリー等を利用して蛍光標識した目的外細胞を検出、分離することが可能になります。しかし、混入する目的外細胞の種類は、目的とする細胞の種類や分化誘導の方法によって異なるため、すべてのケースに共通して使えるマーカーを開発するのは困難です。そのため、各細胞製造プロセスに合わせて、目的外細胞の種類を特定し、それに対応するマーカーを見つけ出す技術が必要とされてきました。
iPS細胞から分化した細胞集団のばらつきを解析する手法としては、細胞ごとの遺伝子発現を可視化して細胞種類を特定する単一細胞RNAシーケンス(scRNA-seq)法が主に用いられてきました。しかし、この手法では細胞内の遺伝子発現情報しか得られないため、細胞表面にあるマーカーの情報は取得することができません。
産総研はこれまでに、1細胞ごとに糖鎖とRNAの発現情報を同時に解析できるscGR-seq法を開発しました(2021年7月27日産総研プレス発表)。また、scGR-seq法にドロップレット技術を導入したドロップレット型scGR-seq法を開発し、処理細胞数を100倍程度(約1万個)に向上することに成功しました(2024年1月15日産総研プレス発表)。今回、再生医療への応用が期待されるiPS細胞から分化誘導された神経細胞集団の解析にscGR-seqを適用し、目的外細胞を見分けるための新しい技術を開発しました。
なお、本研究開発は、独立行政法人 日本学術振興会 科学研究費助成事業「若手研究(22K15660)」(2022-2025年度)、「基盤研究(B)(23K26872)」(2023-2026年度)、「学術変革領域研究(A)(23H04796)」(2023-2024年度)による支援を受けています。
scGR-seq法では、1細胞ごとの遺伝子と糖鎖の発現情報を取得することができます。これにより、解析した細胞集団に含まれる多様な細胞種を網羅的に同定し、さらに特徴的な細胞表面の糖鎖抗原を同定することができます。そこで本研究では、scGR-seq法をiPS細胞由来分化細胞に適用することで、目的外細胞の網羅的同定と細胞表面糖鎖をターゲットとしたマーカー探索を一度の解析で行うことができると考え、その実証を行いました(図1)。
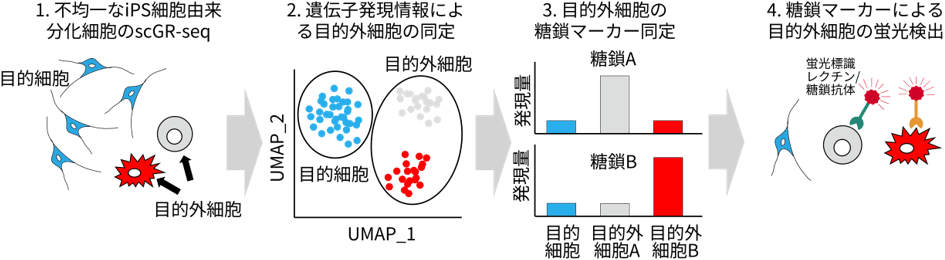
図1 scGR-seqによる目的外細胞の糖鎖マーカー開発の流れ
まず、iPS細胞から神経細胞へ一般的な分化誘導法で作製した細胞集団をscGR-seq法で解析しました。得られた遺伝子と糖鎖の発現情報からUniform Manifold Approximation and Projection(UMAP)法と呼ばれる統計解析手法を用いた結果、全体が4つの細胞亜集団に分類されることが分かりました。各細胞亜集団に高発現する遺伝子を調べることで、細胞亜集団がそれぞれ成熟神経細胞と未成熟神経細胞、未分化神経前駆細胞、間葉系細胞であることを確認しました(図2)。
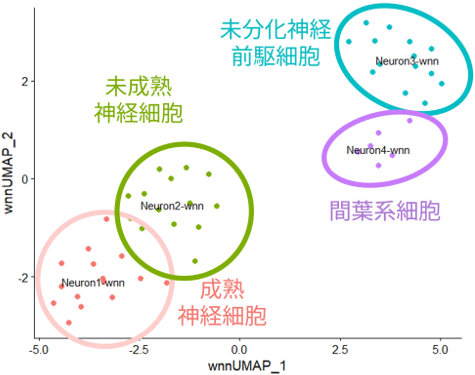
図2 糖鎖とRNAの統合データによる細胞の分類
※原論文の図を引用・改変したものを使用しています。
scGR-seqでは、特定の糖鎖に結合するタンパク質であるレクチンと各細胞の結合の程度を測定することで、細胞ごとの糖鎖発現情報を取得します。図3は、横軸に示された細胞亜集団間で結合強度に差が認められたレクチンについて、それぞれの細胞亜集団における結合強度の大きさを青丸の色の濃さで表しています。未分化神経前駆細胞では青緑色の四角で囲ったrAALとの反応性が高いことが分かります。このレクチンはフコースに特異的に結合することから、フコースが付加されている糖鎖(フコシル化糖鎖)が高発現していることが明らかになりました。さらに詳しく調べたところ、α1,3結合フコースの存在が示唆されました。一方、間葉系細胞では紫色の四角で囲ったレクチンとの結合強度が高かったことから、Poly-LacNAcと呼ばれる糖鎖構造が高発現していることが分かりました。
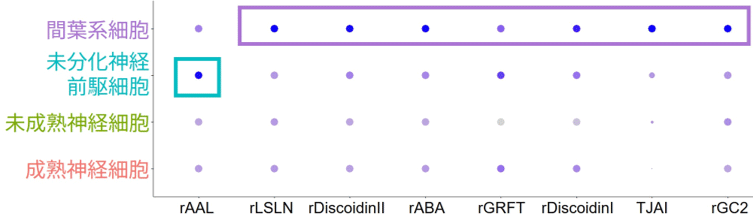
図3 細胞ごとの糖鎖プロファイルのドットプロット図。青丸の大きさが各細胞集団におけるレクチンの陽性率を、青色の濃さがレクチンの結合強度の高さを示す。
※原論文の図を引用・改変したものを使用しています。
次に、α1,3結合フコースと特異的に結合する蛍光標識した抗LewisX抗体と、蛍光標識したPoly-LacNAc結合レクチン(rLSLN)を細胞集団に反応させました。神経細胞とは明らかに形態が異なる未分化神経前駆細胞と間葉系細胞に対して、前者には抗LewisX抗体が、後者にはrLSLNが特異的に染色することを確認しました(図4)。さらに、これらの糖鎖マーカーが、未分化神経前駆細胞や間葉系細胞の他のタンパク質マーカーと一致した染色パターンを示したことから、抗LewisX抗体は未分化神経前駆細胞集団を、rLSLNが間葉系細胞集団を蛍光染色できることが示されました。以上のように、scGR-seq法を適用することで、iPS細胞から誘導した分化細胞の目的外細胞の同定とマーカー開発を同時に行うことができます。本成果は、iPS細胞由来細胞の品質管理や分離技術の高度化に貢献でき、再生医療の安全性と有効性の向上への寄与が期待されます。
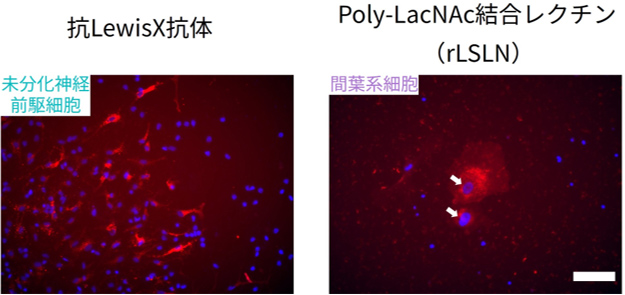
図4 未分化神経前駆細胞に対する抗LewisX抗体の蛍光染色像(左)、間葉系細胞に対するrLSLNの蛍光染色像(右)。青色は細胞核、赤色は抗LewisX抗体またはrLSLNの染色像を示す。白矢印はrLSLN陽性細胞を示す。2枚のスケールは同じで、スケールバーの長さは100 μm。
※原論文の図を引用・改変したものを使用しています。
今後は、iPS細胞由来神経細胞だけでなく、さまざまな再生医療用の細胞に応用することで、より安全で高品質な細胞製品を開発するためのマーカー開発に取り組みます。これにより、細胞の規格設定や評価法の開発、そして治療効果の高い再生医療用細胞の培養技術の開発を目指します。
掲載誌:Stem Cell Reports
論文タイトル:Single-cell glycome and transcriptome profiling uncovers the glycan signature of each cell subpopulation of human iPSC-derived neurons
著者:Haruki Odaka, Hiroaki Tateno
DOI:10.1016/j.stemcr.2025.102631