北海道大学大学院薬学研究院の鈴木利治特任教授(認知症先進予防・解析学分野)、同大学大学院生命科学院博士後期課程(研究当時)の齋藤 遥氏、浜松医科大学の尾内康臣教授、産業技術総合研究所生物プロセス研究部門の羽田沙緒里主任研究員、浜松ホトニクス株式会社中央研究所の塚田秀夫主幹、株式会社ペプチド研究所の熊谷久美子サイエンスアドバイザーらの研究グループは、脳内で分泌されるペプチドの「p3-Alcβ」が神経細胞中のミトコンドリアを活性化することにより、アルツハイマー病の原因因子であるアミロイドβが引き起こす神経毒性を抑制することを見出しました。
脳に薬剤を作用させようとすると、血液中の薬剤は血液脳関門(BBB)という強力なバリアによって通過を制限されます。しかし、末梢投与されたp3-Alcβは、アルツハイマー病のマウスモデルのBBBを透過して、アルツハイマー病によって活性が低下したミトコンドリアを活性化させることが明らかになりました。本研究によって、有効で安価なアルツハイマー病治療薬の開発につながることが期待されます。本研究成果をもとに、経皮投与の製剤化に成功し、臨床試験へ向けた準備を進めています。
なお、本研究成果は、2023年3月30日(木)公開の
EMBO Molecular Medicine誌に掲載されました。
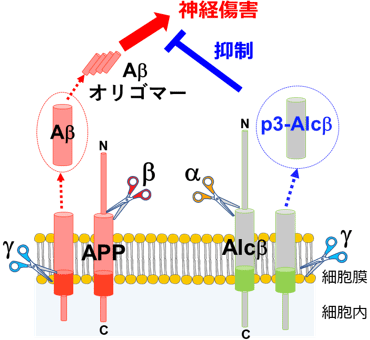
p3-Alcβの産生機構。p3-Alcβは神経膜タンパク質Alcadeinβ(Alcβ)から、Aβは神経膜タンパク質APPから切断酵素による切断を受けて細胞外に分泌される。
日本を含む先進諸国では、急速な高齢化による認知症患者の増加が社会問題となっています。2025年には、65歳以上の認知症患者の約700万人のうち、60〜70%がアルツハイマー病(AD)になると推定されています。AD患者の脳内では、認知症を発症する20年以上も前から、アミロイド前駆体タンパク質(APP)から切り出されたアミロイドβペプチド(Aβ)*1が細胞外に分泌され、多量体(オリゴマー)が形成されます。やがてオリゴマーはより大きな凝集体となり、脳に沈着して老人斑と呼ばれるADに特徴的な病理像が認められるようになります。遺伝子変異を伴う家族性ADの解析などから、Aβオリゴマーが神経細胞のシナプスを傷害し、神経毒性を現すことがAD発症の引き金になるという証拠が積み重ねられてきました。このような経緯から、Aβ凝集阻害物質やAβを認識する抗体など、Aβをターゲットとした治療法の開発が進められてきました。
しかし、形成される多様なAβオリゴマーが様々な標的タンパク質(神経伝達物質受容体など)を介して神経毒性を発現することや、AD発症・悪化のメカニズムには個人差があることなどの複雑性が、有効な治療法の開発を困難にしています。現在開発が進んでいる治療薬の多くは、特定のタイプのAβオリゴマーや凝集体に対して高い結合親和性を示す抗体医薬です。そのため、孤発性AD*2の多様な発症機構の解明とその多様性に対応できる予防・治療法の開発が切望されています。
北海道大学のグループが見出したAlcadeinβ(Alcβ)は神経細胞に特異的に発現する膜タンパク質で、Aβの前駆体膜タンパク質であるAPPを切断する酵素により同じ代謝様式で切断されることによって、p3-Alcβ*3という37-40アミノ酸のペプチドを産生します(p1の図)。p3-AlcβはAβとは異なり非凝集性のペプチドで、脳神経細胞から脳脊髄液中に分泌されます。研究グループは、AD患者の脳脊髄液中でこのペプチドが減少することを明らかにしてきました。本研究では、p3-Alcβの脳内における機能をマウス胎仔脳由来の初代培養神経細胞とADマウスモデルを用いた実験により検証しました。
これまでの研究から、 Alcadeinファミリー分子から産生されるp3-Alcの機能として、Aβの神経毒性を促進するか、もしくは抑制することでADの発症に関わることが予測できました。老化、特にAD発症によりAlcβの発現が低下し、その結果代謝産物であるp3-Alcβの産生も減少します。p3-Alcβの神経細胞に対する効果を調べるために、Aβによる傷害を受けやすい大脳皮質および海馬由来のマウス初代培養神経細胞を使って、加齢やADで低下するミトコンドリア*4の活性を評価する実験を行いました。その結果、37アミノ酸のp3-Alcβ37の添加によって、神経細胞の代謝活性の増加と、ミトコンドリアが産生するエネルギー源であるATP産生量の増加が認められました。神経細胞は分裂による増殖をしないため、これらの細胞生存シグナルの増加は神経細胞のミトコンドリアの活性化を反映しています。
次に、p3-Alcβの37アミノ酸の中から機能部位を決定するために、断片化したペプチドを用いて検証した結果、9〜19番目の11アミノ酸(p3-Alcβ9-19)がその機能部位であることが分かりました。p3-Alcβ9-19は、37アミノ酸のペプチド(p3-Alcβ37)と同様に有意に神経細胞のミトコンドリアを活性化させ、Aβオリゴマーに起因する傷害から神経細胞を保護する作用を有することを見出しました。
さらに、研究グループは、p3-AlcβがAβオリゴマーによる毒性から神経細胞を保護する作用がどのようなメカニズムによるものかを明らかにするために、カルシウムイオンに着目しました。Aβオリゴマーは細胞内への過剰なカルシウムイオンの流入を引き起こし、これが神経変性の引き金となることが報告されています。解析の結果、p3-Alcβ9-19とp3-Alcβ37は、AβオリゴマーによるNMDA型グルタミン酸受容体*5の異常活性化を介したカルシウムの過剰な流入を抑制していました。この新規なメカニズムにより、p3-AlcβがAβの毒性から神経細胞を守ることを明らかにしました。
脳を含む中枢神経に作用する薬剤は、血液成分の中枢神経側への物質移動を制限する血液脳関門(BBB)という機構によって、投与しても作用部位へ十分量が到達できないことが問題となります。しかし、p3-Alcβ9-19を末梢投与したラットではPET*6を用いた脳画像解析で脳のミトコンドリアの活性が上がったことから、p3-Alcβ9-19が中枢神経系に到達し、末梢投与でもBBBを透過して機能を発揮することが明らかとなりました。また、ヒト型の神経毒性を示すAβを産生しない野生型マウスと比較して、低下していたADマウスモデルのミトコンドリアの活性がp3-Alcβの投与によって野生型のレベルにまで回復したことから、個体レベルでもp3-AlcβがAβオリゴマーによる神経毒性から神経機能を保護することが示されました(図1)。
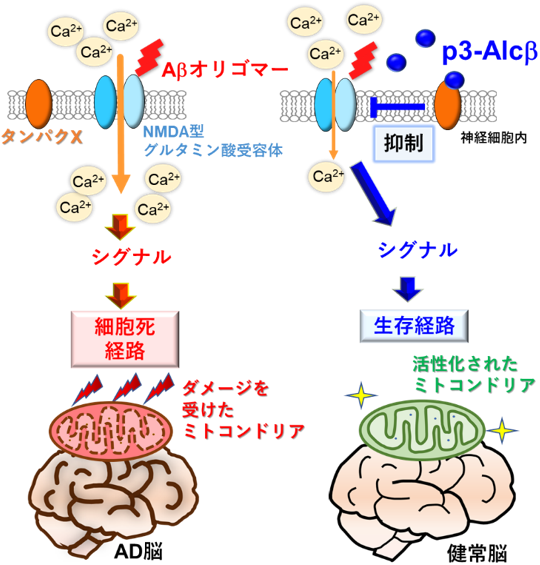
図1. p3-Alcβの作用機構。左:Aβオリゴマーが、NMDA型グルタミン酸受容体を非生理的に活性化し、異常なカルシウム流入を引き起こすことで、ミトコンドリアの機能低下と神経細胞死を誘発する。右:脳内ペプチドp3-Alcβは、NMDA型グルタミン酸受容体の異常活性化を抑制し、Aβオリゴマーによるミトコンドリアの機能低下を防ぎ、神経細胞を健常な状態へ回復する。研究グループは、p3-Alcβが加齢およびADの進行に伴い減少することを解明している。
p3-Alcβは、脳脊髄液中に分泌されて、神経細胞のミトコンドリアの活性化とAβ傷害性に対して保護的な作用を示すペプチドです。加齢やAD発症に伴ってその量が減少します。本研究により、p3-Alcβがこれまでに開発されてきたAD治療薬とは異なるメカニズムでADに有効であることが示唆されました。p3-Alcβを用いることで、ADに有効な新規治療法の開発に結び付く可能性があります(図2)。著者らの研究チームは、現在米国パスポートテクノロジー社と共同で、マイクロポレーション装置(パスポートシステム、下記【関連するプレスリリース】参照) *7を用いたp3-Alcβ9-19の経皮吸収製剤ALC919を開発しており、今後臨床試験を実施する予定です。
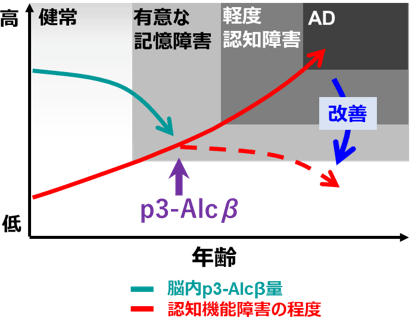
図2. p3-AlcβのAD治療薬としての活用。AD初期患者ではp3-Alcβの低下が認められる。有意な記憶障害が生じる時期からp3-Alcβ(経皮吸収剤名ALC919)を投与することで、ADの進行を遅らせ認知機能障害を抑制する効果が期待できる。
本研究はAMED橋渡し研究戦略的推進プログラム(脳移行性経皮吸収ペプチドを用いたアルツハイマー病治療薬の前臨床試験)、AMED認知症研究開発事業(非病変蛋白脳画像と液性バイオマーカーを取り入れた早期認知症の層別化研究)などの支援を受けて行われました。北海道大学の認知症先進予防・解析学分野は、ジャパン・メディカル・リーフ社の支援による寄附分野です。
北海道大学・PassPort Technology社共同プレスリリース「PassPort Technologiesと北海道大学が脳移行性経皮吸収ペプチドを用いたアルツハイマー病治療薬の共同研究プロジェクトを開始」
発表日:2019年10月8日
URL:https://www.hokudai.ac.jp/news/191008_pr.pdf [PDF:560KB]
論文名 Brain p3-Alcβ peptide restores neuronal viability impaired by Alzheimer’s amyloid β-peptide(脳由来p3-Alcβ ペプチドは、アルツハイマー病のアミロイドβペプチドによって損なわれた神経細胞の生存活性を回復する)
著者名 Saori Hata*1,3, Haruka Saito*2, Takeharu Kakiuchi4, Dai Fukumoto4, Shigeyuki Yamamoto4, Kensaku Kasuga5, Ayano Kimura2, Koichi Moteki2, Ruriko Abe1, Shungo Adachi3, Shoich Kinoshita2, Kumiko Yoshizawa-Kumagaye6, Hideki Nishio6, Takashi Saito7,8, Takaomi C. Saido7, Tohru Yamamoto9, Masaki Nishimura10, Hidenori Taru1, Yuriko Sobu1, Hiroyuki Ohba4, Shingo Nishiyama4, Norihiro Harada4, Hideo Tsukada4, Takeshi Ikeuchi5, Yasuomi Ouchi♯11, and Toshiharu Suzuki♯1(*共同筆頭著者、1北海道大学大学院薬学研究院、2北海道大学大学院生命科学院、3産業技術総合研究所、4浜松ホトニクス株式会社中央研究所、5,新潟大学脳研究所、6株式会社ペプチド研究所、7理化学研究所脳科学総合研究センター、8名古屋市立大学大学院医学研究科、9香川大学医学部、10滋賀医科大学神経難病研究センター、11浜松医科大学光尖端医学教育研究センター、♯共同責任著者)
雑誌名 EMBO Molecular Medicine (ヨーロッパ分子生物学機構の科学誌)
DOI 10.15252/emmm.202217052
公表日 2023年3月30日(木)(オンライン公開)