九州大学大学院工学研究院の黄文敬特任助教、佐久間臣耶准教授、鳥取直友助教、山西陽子教授、産業技術総合研究所生物プロセス研究部門の菅野茂夫主任研究員らの研究グループは、電界により誘起される気泡を制御して、細胞に力学刺激を与えることで、効率的に細胞膜に穿孔し、数メガダルトン注3)の分子を細胞へ導入することに成功しました。
細胞膜穿孔技術は、細胞内で発現した生体分子の活性を可視化するだけでなく、遺伝子操作を可能にする技術でもあります。しかしながら、巨大なゲノム情報を持ちうる大きな分子を細胞へ導入することは困難です。本研究では、この技術を見直すことで、誘電体材料で覆われた微細電極からなるコアシェル構造のマイクロバブルインジェクター(下図)を用いて、エレクトロメカニカルポレーションで細胞に穿孔をつくり、巨大なゲノム情報を持つ大きな分子を細胞へ導入できることを示しました。電極にパルス電圧を印加することで、電極の先端にマイクロバブルが発生し、細胞に電気と機械的刺激を同時に与えることができるようになりました。このような独創的な手法を用いることで、一般に分子の導入が困難とされている骨芽細胞やクラミドモナスにも、数メガダルトンの分子を導入することを可能にしました。特に、細胞懸濁液の粘度を高めること(下図B)で導入効率が向上することを見いだし、これは電界誘起気泡の繰り返しの膨張・収縮(振動波)によって達成されたと推定されます(下図)。さまざまな種類の細胞への適用が可能であることから、新たな遺伝子工学への応用が数多く期待されます。
本研究は、2022年10月20日(日本時間)に英国王立化学会の科学ジャーナル「Lab on a Chip」に掲載されました。
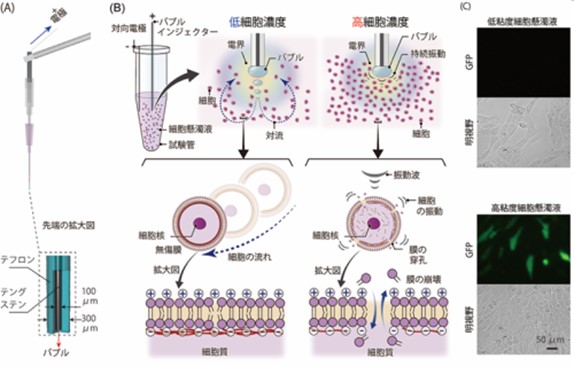
研究成果の概略図
(A)バブルインジェクター。(B)エレクトロメカニカルポレーションの概念図。低濃度または高濃度の細胞の懸濁液は、電界と力学の両方の刺激に同時に曝されます。濃度が低い場合、細胞への機械的刺激が小さいと考えられます。一方、高濃度懸濁液の場合、細胞はバブル周辺に集積し、マイクロバブルの持続的な振動に曝され、膜の穿孔を促進します。
近年、巨大分子および長鎖DNAの生細胞への導入は大きな注目を集めています。細胞膜穿孔技術は、細胞内で発現した生体分子の活性を可視化するだけでなく、遺伝子操作を可能にする技術でもあります。例えば、代表的な穿孔技術としてのエレクトロポレーション注4)により、タンパク質、核酸などを細胞内に導入し、遺伝子操作を行うことができるようになりました。遺伝子編集の最も強力なツールであるCRISPR-Casシステム注5)を細胞内に導入することで、細胞内のゲノムの任意の標的ターゲット遺伝子を操作できます。一般に、CRISPR-Casシステムは、大きな発現ベクター注6)(>10 kbp)によりコードされます。大きな分子を細胞に導入することにより、より高度な遺伝子操作ができれば遺伝子改変操作効率の向上につながります。しかし従来のエレクトロポレーションを用いれば1~100 nmの範囲の膜孔を生成することができますが、大量のゲノム情報を持つ大きな分子をさまざまな細胞種に導入できるかは自明ではありません。
本研究では、誘電体で覆われた微細電極からなるコアシェル構造のマイクロバブルインジェクターを用いた遺伝子導入技術を開発しました。本バブルインジェクターを用いることで、細胞に対して2つの物理的刺激(電気刺激と機械的刺激)を与えることができます。装置にパルス電圧を印加しバブルを発生させる際には、バブルインジェクターの先端では、エレクトロポレーションで用いられるのと同等の電界(数MV/m)が生じ、電界により細胞膜への穿孔が引き起こされることが予想されます。また、電圧印加時に発生したバブルの振動や圧壊により細胞へと力学的な刺激も印加されます。そこで本研究グループは、電界の刺激とバブルによる力学刺激の両方を同時に細胞へ負荷することで、エレクトロポレーションを含むこれまでの導入法よりも導入効率の高いポレーション技術を実現できると考え、エレクトロメカニカルポレーションの確立に取り組みました。
本研究では、細胞懸濁液の粘度を高くすることで、マイクロバブルを繰り返し膨張・収縮させ、細胞への遺伝子導入効率を高くすることを可能としました。図1は構築したエレクトロメカニカルポレーション実験用のプラットホームを示しています。標的分子を含む細胞懸濁液に挿入したバブルインジェクターと対向電極の間にパルス電圧を印加すると、バブルインジェクターの先端に電界が集中し、懸濁液中にマイクロバブルが発生します(図1)。この時、細胞懸濁液の粘性によって、バブル周囲の流体は2通りの挙動を示し、その流体的挙動によって懸濁液中の細胞に対する力学刺激の程度が変化します(研究成果の概略図)。低粘度の懸濁液の場合、発生した気泡は装置先端から順次射出され、その結果、容器(マイクロチューブ)内に循環流が発生します。この時、細胞は流れに沿って移動するため、主に流体せん断力という比較的小さな力学刺激を受けることになります。一方、高粘度懸濁液の場合、気泡はインジェクターの先端で膨張と収縮を繰り返します。これは、細胞懸濁液の粘度が高くなると抗力が高くなり、マイクロバブルの放出が妨げられるためと考えられます。本研究では、細胞や増粘剤の濃度を上げることで、懸濁液の粘度を増加させ、懸濁液中にバブルの振動を伝播させることで、細胞に対して圧力振動による比較的大きな力学的刺激を印加することを可能としました。
提案した遺伝子導入法の有効性を実証する前に、電源の出力パワーの最適化を行いました。2.1×105 cells/μLのNIH/3T3細胞懸濁液(分子導入の実験では7 μLで実施)を用い、出力パワーを4~15 Wまで変化させ、エレクトロメカニカルポレーションによるプラスミド(pEGFP-N1、導入すると細胞が蛍光を示すもの)の導入効率を比較しました。出力を12 Wまで上げると、遺伝子導入された細胞数が増加し、さらに15 Wまで上げると導入された細胞数が減少することが分かりました。12 Wでは約60%の細胞生存率でした。一方、15 Wでは細胞の生存率が約25%に減少しました。さらに、12 Wでのプラスミドの状況を確認したところ、大きな損傷は生じませんでした。これらの結果から、12 Wの出力が最も細胞遺伝子導入に効果的であると考えられ、以降の実験においては12 Wの出力パワーを適用しました。
続いて、粘度の上昇が力学刺激の増強に有効かどうかを調べる実験を行いました。異なる細胞濃度の懸濁液の粘度を評価した結果、せん断粘度は細胞濃度が高くなるにつれて増加することが分かりました(図2)。次に各種濃度においてマイクロバブルの挙動を観察したところ、低細胞濃度では生成したバブルによって循環流が生じるのに対し、細胞濃度が高い場合には、バブルは装置先端で振動し、循環流は発生しませんでした。これらの結果は粘性がバブルの挙動に影響することを示し、溶媒条件を変化させることで分子導入のための力学刺激を調整できることを示しています。高細胞濃度では、低細胞濃度に比して多数の細胞に遺伝子が導入され(図2)、これらの結果は、力学刺激とエレクトロポレーションの組み合わせが導入効率に与える影響を示しており、エレクトロメカニカルポレーションのコンセプトを実証しています。また、増粘剤の添加による粘度変化を評価した結果、細胞懸濁液の粘度はいずれの場合も上昇し、増粘剤を低細胞濃度の懸濁液に投与することで遺伝子の導入効率が向上しました(図4)。マイクロバブルによる細胞への遺伝子導入効率を高める上で、懸濁液の粘度が重要な因子であることが示唆されました。
開発したエレクトロメカニカルポレーションを、さまざまな種類の細胞への導入に応用しました。具体的には、ラットの骨肉腫細胞株(UMR-106細胞)と微細藻類(クラミドモナス、Chlamydomonas reinhardtii)を用いた実験を行いました。まず、異なる細胞濃度または増粘剤を添加したUMR-106細胞の懸濁液を調製し、細胞懸濁液の粘度を評価しました。図4に示すように、UMR-106細胞の細胞濃度が高い場合は、低い場合に比べて粘度が高いことが確認され、高濃度懸濁液(2.1×105 cells/μL)では、バブルが装置先端で振動する様子が観察されました。導入実験をした結果、高粘度の細胞懸濁液の場合、低濃度の細胞懸濁液よりも高い導入効率が実現されました(図4(B))。もうひとつのクラミドモナスは将来の再生可能なバイオ燃料の供給源として示唆されている微細藻類ですが、厚い細胞壁を持つために遺伝子操作が困難とされています。巨大分子の例として、2000-kDaのFITC-dextranをクラミドモナスへ導入することを目指しました。2000-kDaのFITC-dextran分子と混合して静置したサンプルでは、緑色の蛍光を発する細胞がほとんど観察されず、低濃度の懸濁液にバブル処理を実施しても、細胞にわずかにしか導入されないことが確認されました。一方、高濃度の懸濁液を用いた場合では、バブル処理においてFITC-dextranの導入は顕著に上昇することが確認されました(図4C)。このように、本システムは細胞壁を持つ細胞への高分子導入にも適用可能であり、植物細胞であってもサンプルの粘度は遺伝子導入に重要なパラメータであることが分かりました。以上により、エレクトロメカニカルポレーションによってさまざまな細胞種への遺伝子導入が可能であることが確認されました。

図1
システム構成とバブルの発生。赤い矢印:細胞導入ユニットの拡大図。プラスミド導入に使用したシステムの構成:電源、2台のマイクロマニピュレーター、バブルインジェクター。
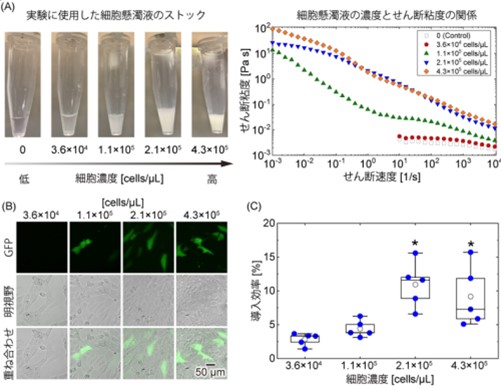
図2
細胞濃度がプラスミド導入効率に与える影響。
(A) (左)マイクロチューブ内の低濃度から高濃度までの細胞懸濁液の画像。(右)レオメーターで測定した細胞懸濁液の粘度。
(B) 異なる細胞濃度でプラスミドを導入したNIH/3T3細胞の画像(導入後24時間)。
(C) 異なる細胞濃度でプラスミドを導入したNIH/3T3細胞の導入効率。*:p < 0.05 vs. 3.6×104 cells/μL。
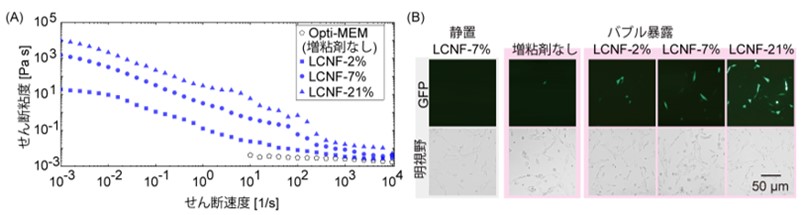
図3
NIH/3T3細胞へのプラスミドの導入における増粘剤の効果。
(A) 増粘剤の濃度と粘度の関係。LCNF:増粘剤long cellulose nanofiber。
(B) 異なる濃度の増粘剤の投与とプラスミドの導入効果を示すNIH/3T3細胞の画像。細胞濃度:低細胞濃度。
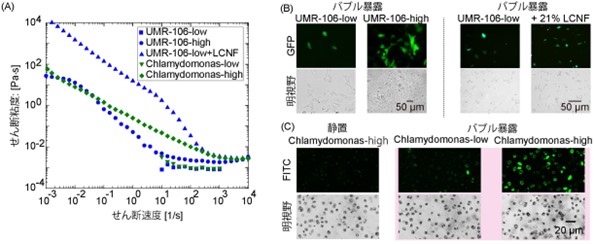
図4
UMR-106およびクラミドモナスへの導入における細胞濃度または増粘剤の添加の影響。
(A) UMR-106細胞またはクラミドモナスの粘度の測定。
UMR-low/high:低及び高濃度のUMR-106細胞懸濁液。
Chlamydomonas-low/high:低及び高濃度のクラミドモナス細胞懸濁液。
(B) UMR-106細胞への導入に対する細胞濃度または増粘剤の添加の影響。
(C)低/高細胞濃度でのChlamydomonasへの導入。FITC: 2000 kDa FITC標識デキストラン。
タイトル: Viscosity-aided electromechanical poration of cells for transfecting molecules
著者:Wenjing Huang, Shinya Sakuma, Naotomo Tottori, Shigeo S. Sugano and Yoko Yamanishi
掲載誌:Lab on a chip
DOI:10.1039/d2lc00628f
本研究は、JST戦略的創造研究推進事業(CREST、JPMJCR19S6)の支援を受けて行われました。