NEDOの「IoT社会実現のための革新的センシング技術開発」で、産総研と埼玉大学はこのたび、測定時間1分でインフルエンザウイルスを検出できる超高速ウイルス検出法と、PCR法を超える検出下限100コピー/mLの感度を実現した超高感度ウイルス検出法をそれぞれ開発しました。開発した検出法は、施設などの入り口で来訪者のウイルス保有の可能性を“その場検査”するといった、効果的な感染対策の実現につながることが期待できます。
今後は、新型コロナウイルスやノロウイルスなどを対象とした検出法の実証に取り組むとともに、微量のウイルスをその場で検出可能なシステム“ウイルスゲートキーパー”の実用化に向けた研究開発を進める予定です。
2019年から続く新型コロナウイルス感染症(COVID-19)は、全世界の多方面へ大きい影響を及ぼしています。こうした事態を受け、現在は施設の入り口などに設置した表面温度計による検知で、ウイルス感染が疑われる人の入場を防ごうとする対策が取られています。これを温度という副次的な指標ではなく、ウイルス保有か否かをその場で直接評価できるようになれば、より効果的にウイルスの持ち込みを防止できると考えられます。一方、現在広く用いられているスクリーニング検査のためのイムノクロマトグラフィー法※1(迅速抗原検査キットで使用)、あるいは確定検査のためのPCR法※2では、“その場検査”に求められる迅速な測定と高い検出感度の両立が課題となっていました。
このような背景の下、NEDO(国立研究開発法人新エネルギー・産業技術総合開発機構)の委託事業「IoT社会実現のための革新的センシング技術開発」の中で、国立研究開発法人産業技術総合研究所(産総研)と国立大学法人埼玉大学(埼玉大学)はコニカミノルタ株式会社、株式会社ワイエイシイダステックと共同で、施設などの入り口に設置することで来訪者のウイルス保有の可能性を1分で検知可能なシステム“ウイルスゲートキーパー”の研究開発に取り組んでいます。ウイルスゲートキーパーは、来訪者が綿棒を口にくわえて唾液を採取し、それを装置にセットするだけで、1分後にウイルス保有リスクを自動判定する装置です。このシステムの実現に向けた研究開発の中で、産総研と埼玉大学はデジタル検出法※3と呼ばれる高感度バイオセンシング法をベースに、二つの新しいウイルス検出法を開発しました。
なお、本成果の詳細は2022年5月12日に「Analytica Chimica Acta」に掲載されました。
本事業で産総研はデジタル検出法に、埼玉大学が開発した凝集誘起発光(AIE)試薬※4を取り入れることで、従来の迅速抗原検査キットに比べて格段に高速となる、1分以内にウイルスを検出できる新たな手法を開発しました。さらに産総研は、デジタル検出法に高濃度の磁気微粒子※5を用いる増感技術を組み合わせた新規検出法により、従来のPCR法を超える検出下限100コピー※6/mLの超高感度ウイルス検出を実現させました。これらの検出法で、唾液検体中のウイルスが検出できることも確認しています。
(1)超高速ウイルス検出法の開発
産総研が開発したデジタル検出法は、マイクロメートルサイズの微小穴(ウェル)の配列(アレイ)(図1)を用いたものです。ウェル1個あたりの体積は0.5pL(ピコリットル、1兆分の1Lのこと)とし、ここにウイルスと検出試薬を閉じ込めることで高いコントラストでの光信号検出が可能となりました。また、埼玉大学が開発したAIE試薬は、10秒以内にウイルスと反応して素早く蛍光信号を発生します。デジタル検出法にこのAIE試薬を取り入れることで、超高速ウイルス検出の実現を目指しました。開発した検出法でインフルエンザウイルスの検出試験を行った結果、アレイ中のウェルが発光する様子(図2(A)参照)が観察されました。このような発光ウェル(図2(B)にカラーで表示)にはウイルスが閉じ込められていることが示され、その数を数えることでウイルス濃度が定量評価できます。ウイルス濃度に対する発光ウェルの数から評価した、検出下限のウイルス濃度は3×105コピー/mLであり(図2(C))、これは、従来の迅速抗原検査キットの検出下限(106~107コピー/mL、測定時間は15~30分)を超える検出感度です。測定時間も、検体の前処理や発光観察の時間を合わせて1分以内に完了できる見込みで、従来のキットよりも高感度なウイルス検出が10分の1以下の測定時間で実施できることになり、この成果はウイルスゲートキーパーの実現につながると期待できます。

図1 ウェルアレイの電子顕微鏡像、(A)上面図と(B)断面図
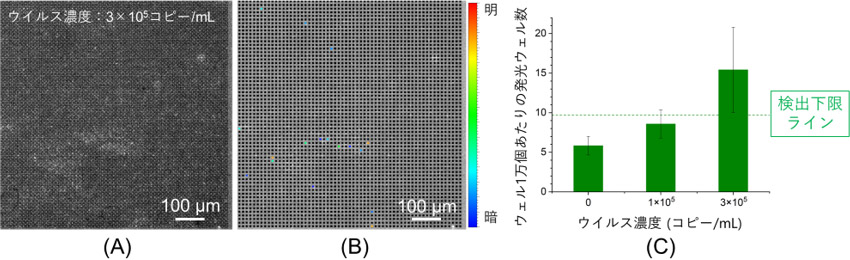
図2 ウェルアレイとAIE試薬を用いて測定した(A)蛍光像、(B)発光ウェルをカラーで表示した(A)の解析図、(C)(B)の発光ウェル数の解析に基づく、インフルエンザウイルス検出結果
(2)超高感度ウイルス検出法の開発
産総研は上述の超高速ウイルス検出法で用いたものと同じウェルアレイを用いて、PCR法を超えるような感度を目指した、超高感度ウイルス検出法の開発も行いました。ウイルス検出では高感度化のために、目的のウイルスだけに結合する微粒子を用いてウイルスを捕集することがしばしば行われますが、なかでも磁気微粒子は、磁場による微粒子の制御が可能であるため特に有効です。磁気微粒子を用いる場合、従来のデジタル検出法では一つのウェルに1個の磁気微粒子が格納されるのが一般的でした。産総研は一つのウェルに多数の磁気微粒子を格納する“多粒子格納デジタル検出法”を提案しました(図3(A))。この方法では従来法より高濃度の磁気微粒子を用いることで素早く多数のウイルスを捕捉することができます。ウイルスと磁気微粒子のブラウン運動※7に基づく理論計算とウイルス捕捉実験では、短時間(数分以内)でウイルス捕捉を完了するためには、従来法より2桁以上高い濃度(1億個/mL以上)の磁気微粒子を用いるのが重要であることが明らかになりました。また、ウイルス検出試薬として蛍光基質※8MUNANA※9を用いて、多粒子格納デジタル検出法によるインフルエンザウイルスの検出試験を行った結果、MUNANAとウイルスとの反応により発光するウェルが観察されました。ウイルス濃度に対する発光ウェルの数から評価した検出下限のウイルス濃度は100コピー/mL(図3(B))であり、PCR法(検出下限はおよそ1000コピー/mL)を超える超高感度のウイルス検出を達成しました。測定時間については、現在の検出手順では約30分を要しますが、検出システムの最適化により2分の1から5分の1程度まで短縮できる見込みです。本検出法は、スクリーニング検査よりも高い検出性能が求められる確定検査などへの展開が期待できます。
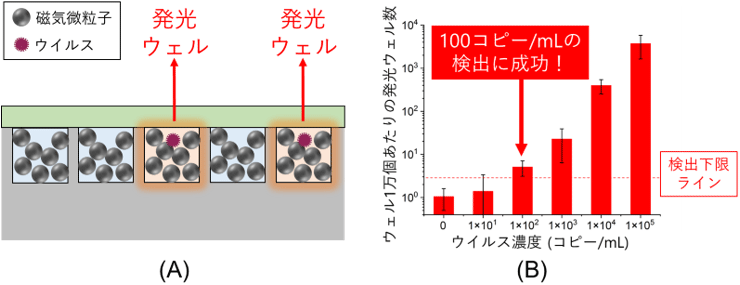
図3 多粒子格納デジタル検出法の(A)ウェルアレイ断面の概要図、(B)インフルエンザウイルス検出結果
今回超高速検出と超高感度検出を実現したインフルエンザウイルスに加え、今後は新型コロナウイルスやノロウイルスなどを検出するための実証を進めます。また、開発した検出法を要素技術として、まずは用途に応じた性能(超高速または超高感度)の検査装置、将来的にはこれらを統合した検査装置の実現を目指して、ウイルスゲートキーパーの実用化に向けた研究開発を進めます。