東京大学大学院理学系研究科の合田圭介教授が率いる研究グループは、極めて高い再現性、感度、均一性、生体適合性、耐久性を持つ表面増強ラマン分光法(Surface-Enhanced Raman Spectroscopy: SERS)(注1)の基板を開発し、化学(特に微量分析)における50年来の難問を解決しました。
1970年代に発見されたSERSは、金属基板上の局在表面プラズモン共鳴(Localized Surface Plasmon Resonance: LSPR)(注2)により、通常のラマン分光法(注3)よりも数桁以上高い感度を提供することができ、無標識の微量分析に有効として、利用されてきました。しかしながら、SERSはその高い感度をホットスポット(注4)に強く依存する上、低再現性、不均一性、低生体適合性、金属基板による光熱、酸化などの本質的な問題があり、生体分子への応用が困難でした。
本研究では、これらの問題を克服するために、金属を一切使わない多孔質炭素ナノワイヤをアレイ状に配列したナノ構造体(Porous Carbon Nanowire Array: PCNA)をSERS基板として開発し、これによってLSPRを使わない高感度化を可能にしました。具体的には、強力な広帯域電荷移動共鳴による感度増強(約106)のみならず、上述の金属基板による問題を克服し、極めて高い均一性、生体適合性、耐久性を、さまざまな分子サンプルを用いて実証しました(図1)。
本手法の高い実用性及び信頼性により、分析化学、食品科学、薬学、病理学などの多岐に渡る学術分野に加え、感染症検査、糖尿病検査、がん検診、環境安全、科学捜査などにおける微量分析への展開が期待されます。例えば、血中グルコースの無標識検出による糖尿病検査、感染症(インフルエンザ、新型コロナウイルス感染症など)の抗原抗体反応測定、がん代謝プロファイリング解析、細菌(大腸菌、ピロリ菌など)の表面タンパク質を検出することによるリアルタイム細菌検出、光合成生物の生体分子の分子振動計測による量子生命科学研究、などが可能となります。
本研究は、日本学術振興会(JSPS)の研究拠点形成事業と科学研究費助成事業(JP18K13798、 JP20K14785)、文部科学省の光・量子飛躍フラッグシッププログラム(Q-LEAP)、村田科学技術振興財団、ホワイトロック財団、東京大学GAPファンドプログラム、神奈川県立産業技術総合研究所(KISTEC)、中谷医工計測技術振興財団、小笠原科学技術振興財団、中国国家自然科学基金(21671020、61805175)、中国北京市自然科学基金の支援を受けて実施されました。
本研究成果は、2020年9月24日(午後6時)にNature Communicationsのオンライン版で公開される予定です。

図1:本研究の概念図
1970年代に発見された表面増強ラマン分光法(SERS)は、金属基板上の局在表面プラズモン共鳴により、通常のラマン分光法よりも数桁以上高い感度を提供することができ、無標識の微量分析に有効であるが、低再現性、不均一性、低生体適合性、金属基板による光熱、酸化などの本質的な問題があった。本研究では、これらの問題を克服するために、金属を一切使わない多孔質炭素ナノワイヤをアレイ状に配列したナノ構造体(Porous Carbon Nanowire Array: PCNA)をSERS基板として開発し、微量分析において約6桁の感度増強のみならず、極めて高い再現性、均一性、生体適合性、耐久性を実証した。本手法の高い実用性及び信頼性により、分析化学、食品科学、薬学、病理学などの多岐に渡る学術分野に加え、感染症検査、糖尿病検査、がん検診、環境安全、科学捜査などにおける微量分析にも有用である。
1)研究の背景と経緯
1970年代に発見されたSERSは、金属基板上のLSPRにより、通常のラマン分光法よりも数桁以上高い感度を提供することができるため、無標識の微量分析(場合によっては10桁以上の高感度で1分子計測)に有効でした。しかしながら、その高い感度増強が金属ナノ粒子の集合体や人工金属ナノ構造からのホットスポットへ依存する上(感度増強度とホットスポット依存はトレードオフの関係)、金属基板の表面は酸化しやすく、金属基板による光熱は、熱によるタンパク質変性などを起こし、生体分子にとって有害です。このような従来のSERSの金属基板は、低再現性、不均一性、低生体適合性、耐久性の低さによって利点が著しく損なわれています。これまで、これらの問題を克服するためにさまざまな試みがなされてきましたが、均一な感度増強を示す高密度のホットスポットを必要とするため、高い再現性、均一性、生体適合性、耐久性を同時に達成するSERS基板の開発は依然として難しいと考えられてきました。特にSERS基板の信頼性は、SERSデータから有用な情報を取り出し、定量的に分析・理解し、正確な結論に到達する一連のプロセスの中でも特に重要な鍵となり、この問題は生体応用する際に、より顕著になります。近年、上記の問題を解決するための代替SERS基板として、シリコンやゲルマニウムナノ構造体、二次元材料(グラフェン、MoS2、h-BNなど)、半導電性金属酸化物などの非金属材料が提案されてきました。これらの基板は、LSPRに依存している金属基板とは異なり、構造共鳴や電荷移動共鳴に由来する最大5桁程度の感度増強が実証されました。しかしながらこれらの基板は、部分的に生体適合性を向上させる一方で、その固有の光触媒活性と基板が持つ生体分子に対する有害性を原因として、再現性の低さは依然として問題でした。
2)研究の内容
本研究では、金属基板、半導体基板、誘電体基板とは異なるアプローチをとり、極めて高い再現性、感度、均一性、生体適合性、耐久性を持つSERSの基板として、2次元の配列からなるPCNAによる、LSPRに依存しないトポロジカルに調整されたナノ構造体の開発に成功しました(図2)。PCNA基板は、金属基板に基づく従来のSERSの電磁場増強とは対照的な、強力な広帯域電荷移動共鳴による大きな化学的増強によって高い感度増強(〜106)を持つことを、実験的に示しました。その上、再現性も非常に高く、基板全面を活性化することで、従来SERSの電磁場由来のホットスポットによって実現不可能であった、スペクトルにおける基板間、スポット間、サンプル間における一貫性や、時間によらない一貫性を示しました。さらに酸化によって失われていた耐久性、光熱によって損なわれていた生体適合性を、大幅に改善しました。本研究では、これらの優れた特性を、ローダミン6G(注5)(図3)、β-ラクトグロブリン(注6)(図4)、グルコース(注7)(図4)などさまざまな分子を用いて実験的に実証しました。PCNA基板は1基板あたり約1,000円で安価に大量生産することが可能です(図2)。本研究で開発されたPCNA基板は、SERSの約50年来の難問を解決し、極めて高い再現性、均一性、生体適合性、耐久性を同時に実現しました。
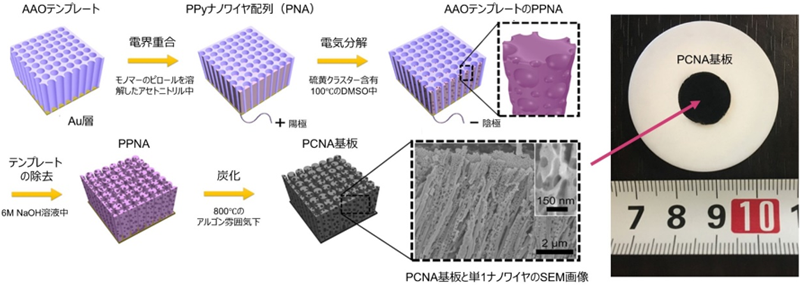
図2:PCNA基板とその製造方法
1基板あたり約1,000円で製造。安価に大量生産することが可能。AAO (anodic aluminium oxide):陽極酸化アルミナ、PPy (polypyrrole):ポリピロール(導電性ポリマー)、PNA (polypyrrole nanowire array):ポリピロールナノワイヤ配列、PPNA (porous polypyrrole nanowire array):多孔性ポリピロールナノワイヤ配列、DMSO (dimethyl sulfoxide):ジメチルスルホキシド(有機・無機化合物を溶かす非プロトン性極性溶剤)。
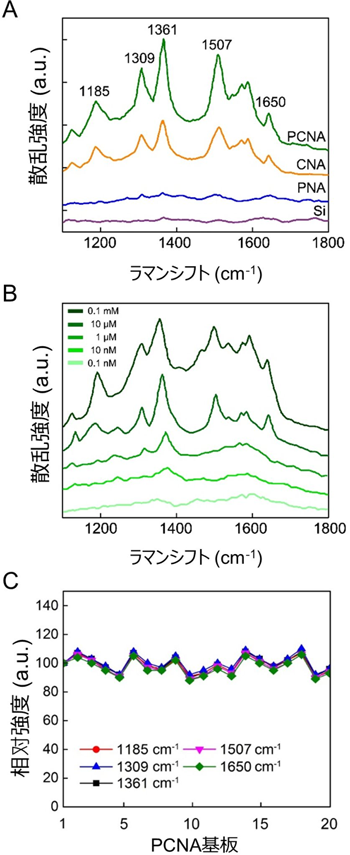
図3:PCNA基板を用いたローダミン6G分子の微量分析
A. 4種の基板(シリコン基板、PNA基板、CNA基板、PCNA基板)上で測定した、ローダミン6G(10µM)のラマンスペクトル(励起波長785nm、励起強度1mW、積算時間30秒)。
B. 異なる濃度のローダミン6GのPCNA基板上におけるラマンスペクトル(励起波長785nm、励起強度1mW、積算時間30秒)。ローダミン6Gの検出限界は0.1nM未満。
C. 20もの異なるPCNA基板で行ったSERSの再現テスト。各基板間における1185、1309、1361、1507、1650 cm-1でのラマンピークの相対強度差は±10%の範囲に収まっている。
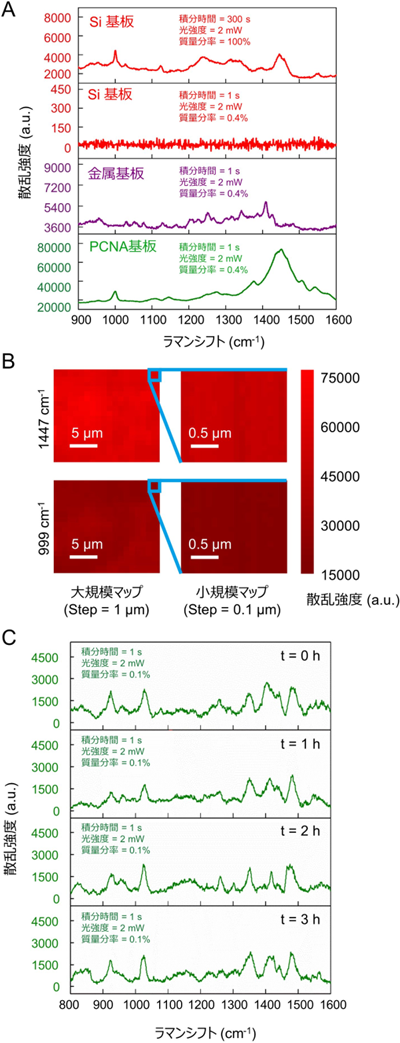
図4:PCNA基板を用いた生体分子(β-ラクトグロブリンとグルコース)の微量分析
A. 3種の基板(シリコン基板、PCNA基板、市販の金属基板)上におけるβ-ラクトグロブリン分子のラマンスペクトル。約6桁の感度増強が示されている。
B. β-ラクトグロブリン分子を用いたPCNA基板におけるSERS強度の空間分布(変動係数<9%)。SERS強度の高い均一性を示している。
C. グルコース分子を用いたPCNA基板におけるSERS強度の安定性。
3)今後の展開
PCNA基板の極めて高い再現性、均一性、生体適合性、耐久性に加え、現在の106程度の感度増強は、市販の金属SERS基板の感度増強に匹敵するか、それ以上であるため、低濃度での生体分子のラマン分光法への実用には十分だと考えられます。PCNA基板の組成(ドーパントの種類やドーピングレベルなど)や構造(多孔質ナノワイヤの形状など)を最適化したり、感度増強がプローブされた分子に依存するように(例えば、波長がチューニング可能なレーザーを介して)電荷移動共鳴に最適な波長の励起レーザーを採用したり、基礎原理をより理解するために電荷移動共鳴の理論を改善することで、より高いSERSの感度増強を得ることが期待できます。このように改良することで、PCNA基板を用いたSERSは、高い実用性及び信頼性により、分析化学、食品科学、薬学、病理学、環境安全、科学捜査などの多岐に渡る分野における微量分析への展開が期待されます。例えば、血中グルコースの無標識検出による糖尿病検査、感染症(インフルエンザ、新型コロナウイルス感染症など)の抗原抗体反応測定、がん代謝プロファイリング解析、細菌(大腸菌、ピロリ菌など)の表面タンパク質を検出することによるリアルタイム細菌検出、光合成生物の生体分子の分子振動計測による量子生命科学研究、などが可能となります。
4)研究チーム
本研究チームの構成員は、Nan Chen(研究当時:東京大学大学院理学系研究科化学専攻・客員研究員)、Ting-Hui Xiao(東京大学大学院理学系研究科化学専攻・助教/量子科学技術研究開発機構・協力研究員)、Zhenyi Luo(研究当時:東京大学大学院理学系研究科化学専攻・修士課程学生)、北濱康孝(研究当時:東京大学大学院理学系研究科化学専攻・特任研究員)、平松光太郎(東京大学大学院理学系研究科スペクトル化学研究センター・助教/国立研究開発法人科学技術振興機構・さきがけ研究員/神奈川県立産業技術総合研究所・非常勤研究員)、岸本直樹(東北大学大学院理学研究科化学専攻・准教授)、伊藤民武(国立研究開発法人産業技術総合研究所健康医工学研究部門・上級主任研究員、 Zhenzhou Cheng(研究当時:東京大学大学院理学系研究科化学専攻・助教)、合田圭介(東京大学大学院理学系研究科化学専攻・教授/カリフォルニア大学ロサンゼルス校工学部バイオエンジニアリング学科・非常勤教授/武漢大学工業科学研究院・非常勤教授/量子科学技術研究開発機構・協力研究員)でした。
合田 圭介(東京大学大学院理学系研究科化学専攻・教授/カリフォルニア大学ロサンゼルス校工学部生体工学科・非常勤教授/武漢大学工業科学研究院・非常勤教授/量子科学技術研究開発機構・協力研究員)
肖 廷輝(東京大学大学院理学系研究科化学専攻・助教/量子科学技術研究開発機構・協力研究員)
伊藤 民武(国立研究開発法人 産業技術総合研究所 健康医工学研究部門 バイオセンシング研究グループ・上級主任研究員)
平松 光太郎(東京大学大学院理学系研究科スペクトル化学研究センター・助教/国立研究開発法人科学技術振興機構・さきがけ研究員/神奈川県立産業技術総合研究所・非常勤研究員)
雑誌名:Nature Communications
論文タイトル:Porous carbon nanowire array for surface-enhanced Raman spectroscopy
著者:Nan Chen, Ting-Hui Xiao, Zhenyi Luo, Yasutaka Kitahama, Kotaro Hiramatsu, Naoki Kishimoto, Tamitake Itoh, Zhenzhou Cheng, and Keisuke Goda*
DOI番号:10.1038/s41467-020-18590-7
アブストラクトURL:https://doi.org/10.1038/s41467-020-18590-7