国立研究開発法人 産業技術総合研究所【理事長 石村 和彦】(以下「産総研」という)細胞分子工学研究部門【研究部門長 宮崎 歴】ステムセルバイオテクノロジー研究グループ 木田 泰之 研究グループ長、森 宣仁 研究員、赤木 祐香 研究員、髙山 祐三 主任研究員は、実際の臓器と似た構造の血管をもつ組織を人工的に作る技術を開発した。
今回、送液ポンプと接続できる組織培養デバイスの中で、組織や血管の元になる細胞とコラーゲン(組織ゲル)を混ぜ合わせて培養して、人工的な組織に大きな血管(主血管)とそこから枝分かれする毛細血管を作製する技術を開発した。血管を通じて培養液を流すことで、酸素や栄養を供給して大きな組織を維持したり、試験の対象である薬剤を流し入れたりすることができる。この技術は、創薬や再生医療分野への貢献が期待される。
なお、この技術の詳細は、2020年4月14日(イギリス夏時間)にScientific Reports誌で発表される。
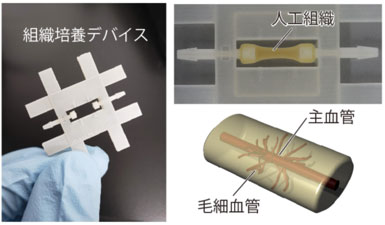
今回用いた組織培養デバイスと作製した血管を持つ人工組織
医薬品開発、再生医療、がん研究といった分野では、細胞と組織ゲルを組み合わせてヒトの臓器や腫瘍を模倣する人工組織「3次元組織」が注目を集めている。3次元組織は医薬品の検査や、失った臓器・組織の置き換え、抗がん剤の試験といった応用が期待されている。しかし、これらの3次元組織に、実際の組織にある動脈のように送液できる大きな血管(主血管)と、そこから枝分かれする毛細血管を作ることは困難であった。このため、失った臓器・組織を治療するための大きく分厚い3次元組織を作って効率よく酸素と栄養を供給したり、また医薬品の試験のため3次元組織の内側に薬剤を流し込んだりすることは難しかった。
産総研は、幹細胞などの研究や培養デバイスの加工技術を応用し、新しい機能を持った細胞の作製や3次元組織の開発、培養デバイスや医療機器の開発と、それらの応用を目指した研究開発を推進してきた。今回、3次元組織が持つ課題に対して、これまでの研究開発で培った技術を活用して血管作製技術の開発に取り組んだ。
なお、今回の開発は、独立行政法人 日本学術振興会の助成金(18K14102)と、国立研究開発法人 日本医療研究開発機構の委託事業「防御シールドを形成し、免疫監視を回避するがん微小環境の理解と医療シーズへの展開(2018~2020年度)」による支援を受けて行った。
今回、産総研では独自に開発した組織培養デバイスを用いて、3次元組織に実際の臓器と同じような主血管と毛細血管を作る方法を開発した(図1)。臓器の機能を担う実質細胞、血管の元になる血管内皮細胞、血管の形成を助ける間葉系幹細胞を培養皿で増やした後、コラーゲンと混ぜて培養デバイスに流し込んで3次元組織を作った。この3次元組織にあらかじめ埋め込んでおいたニードルを引き抜いてトンネルを作り、そこに培養デバイスの流路から血管内皮細胞を流し込んだ。そのまま2時間程度、培養することで、トンネルの壁を覆うように血管内皮細胞を接着させて主血管とした。その後、培養デバイスに培養液を流しながら培養することで、主血管の周りの血管内皮細胞の活動を促進して毛細血管を作らせた。なお、培養液からの酸素・栄養の供給や、流れから受ける刺激によって血管内皮細胞が活性化されるものと思われる。このようにして作製した3次元組織は、培養デバイスで培養液を流しながら1週間程度維持することができた。
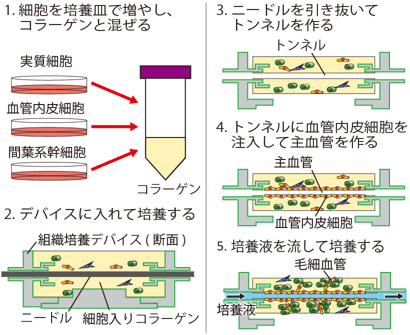
図1 組織培養デバイスを使った主血管と毛細血管の作製方法
培養液を流しながら培養した3次元組織を顕微鏡で観察すると、主血管から毛細血管が枝分かれしている様子が観察できた(図2)。また、今回は実質細胞として肝臓に由来する細胞(肝細胞や肝がん細胞)を使うことで、組織の中で肝臓の機能を示すタンパク質の発現や、薬剤の代謝を計測できた。この技術は細胞の種類やデバイスの形を変えることで、肝臓だけでなく膵臓や脳などのさまざまな臓器の一部を模した組織や、膵がん、脳腫瘍などを作ることができる。このことから、医薬品開発の試験、抗がん剤の評価に利用できると考えられる。また、iPS細胞を用いることで、再生医療における移植組織の作製への活用が期待できる。
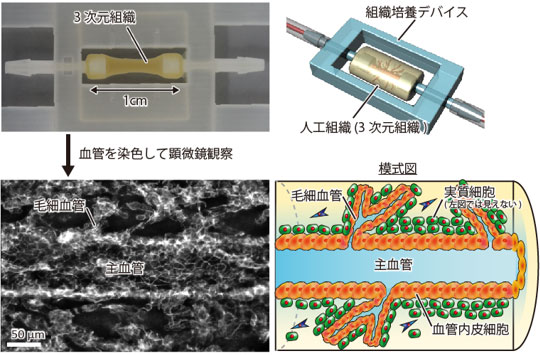
図2 主血管と毛細血管の観察像
今後は、より大きな組織(臓器)の作製や、がんモデルでの抗がん剤の評価を行う。また、iPS細胞由来の細胞を用いた組織の大量生産・高機能化や、他のさまざまな種類の細胞を材料に使って脳や膵臓、小腸を作製する。
培養デバイスの改良も推進して、安定的に長期間の組織培養を行うため、主血管を支えるステントを設けたり、デバイスの大きさや形状を変化させて、さまざまな形の3次元組織を構築することを目指す。