独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)生物機能工学研究部門【部門長 巌倉 正寛】と年齢軸生命工学研究センター【センター長 倉地 幸徳】は、産総研で考案した独自のアルゴリズムに基づいて、10個のアミノ酸で構成される新規の非環状ペプチドを設計・合成し、このペプチドが水溶液中で安定な立体構造を形成すること、及び、昇降温に伴い可逆的かつ協同的に変性/再生することを証明した【図1】。
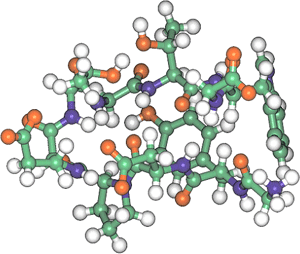 |
図1 設計したペプチド、「シニョリン」の立体構造
(PDB登録番号:1UAO)
|
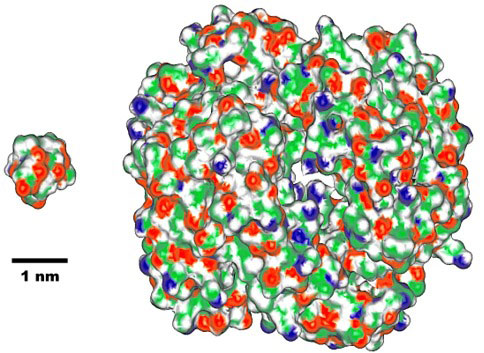
生命の起源と深く関連するタンパク質が、どのように誕生して今日見られる洗練した機能分子へと進化したのかは大きな謎である。今回設計・合成したペプチド(分子量約1000)は、通常自然界に現存するタンパク質(分子量5000~150000)に比べて極端に小さい【図2】。しかし、固有の立体構造と協同的な構造転移は、タンパク質が機能するための不可欠な要件であることから、この2点で判断すれば、合成したペプチドを最小のタンパク質と呼ぶこともできる。
これまで、一般にタンパク質が安定な立体構造を形成するには、30~50個のアミノ酸が最低必要であるとの見方が支配的であった。しかし、合成したペプチドは、この下限を大きく下回るもので、タンパク質の構造単位に関する従来の認識の修正を促すものである。この研究成果により、タンパク質の安定化機構、フォールディング、分子設計研究の進展が今後加速するとともに、生命起源の研究へも大きな影響を及ぼすことが期待される。
|
|
|
図2 シニョリン(左:アミノ酸10個)と代表的なタンパク質であるヘモグロビン(右:アミノ酸574個)の分子の大きさの比較(1nmは10億分の1メートル)
|
本研究成果は、米科学誌ストラクチャーの2004年8月10日号*に掲載された。
*Honda, S., Yamasaki, K., Sawada, Y. and Morii, H. (2004) 10-residue folded peptide designed by segment statistics. Structure 12(8) 1507-1518.
タンパク質は、生命を担う最も重要な物質のひとつであり、また、その機能の発現には固有の立体構造の形成が必須であることが知られている。タンパク質は、化学的には鎖状の高分子である。そのひも様の分子が、いかなる分子機構を経て自ら折りたたみ、最終的にどのような立体構造になるのかという疑問は、フォールディング問題とも呼ばれ、分子生物学における未解決問題の一つである。また、私たちが現在知る複雑で精緻なタンパク質の立体構造が、どのような過程を経て出現したのかというタンパク質の化学進化の問題も、生命の起源と関連した興味深い課題である。両問題とも全容の解明には至ってないが、着実な進展が続いており、現在は共にその初期過程に起こる(起こった)事象の解明に多くの研究者の関心が向いている。これらの研究は、基礎的な側面のみならず、そのプロセスの理解が新たなタンパク質を創出するための技術基盤に直結することから、医薬・農林水産等をはじめとする産業界からも注目される分野となりつつある。
産総研生物機能工学研究部門では、以前よりタンパク質のフォールディングに関連した研究を精力的に展開しており、多くの国際的な成果を上げてきている。これらの研究を通じて、当該部門の本田真也主任研究員らは、フォールディングの初期過程とタンパク質の化学進化の初期過程には共通の分子論的機構が成立しうるとの考えに至り、その発展からタンパク質の自律要素仮説を提案した。この仮説では、タンパク質分子は、一般に考えられているよりもっと小さいサイズの単位で構成される階層的構造体であると解釈している。今回、この仮説に立脚して通常困難と考えられているサイズのタンパク質を設計・合成することを試みることにより、本仮説の妥当性を検証することとした。
ある種のタンパク質のフォールディングの初期過程では、「核」と呼ばれる特定の部位が全体に先立って立体構造を形成することがわかっていた。もし、フォールディングの初期過程と分子進化の初期過程の間に何らかの関係が存在するのであれば、「核」部位の構造的保存性は、他の部分に比べて高いことが予想される。そこで、あるタンパク質の「核」部位と類似の立体構造をもつ断片を、コンピュータを用いてタンパク質構造データベースの中から抽出した。研究に着手した時点では、この目的に沿うソフトウエアは存在しなかったため、独自のアルゴリズムを考案し専用のコンピュータプログラムを開発した。抽出した多数の断片の統計的解析から、それらのアミノ酸配列には有意な偏りがあること、さらにこの偏りは部分構造の安定性を半定量的に反映していることが明らかになった。このような独自のコンピュータ解析を通じて、安定な構造形成が期待される新規なアミノ酸配列を設計し、「シニョリン(chignolin)」と命名した。
合成したシニョリンが水溶液中で溶解することを確認した後、核磁気共鳴法によりその立体構造を解析した。得られた構造データのばらつきはわずかで、天然のタンパク質と同程度の精度の原子座標が決定された。また、シニョリンの変性/再生過程を詳細に解析したところ、分子全体が協同的に変化し、二状態性構造転移を示すことも明らかとなった。この転移現象は緩やかで広い温度範囲に及ぶが、平衡状態にあるシニョリン分子の2割程度は、100℃においても立体構造を維持している。短鎖のペプチドであるシニョリンが高温下でも安定に存在するという事実は、生命の起源の有力な説である海底熱水噴出孔仮説と関連して興味深い。
現在、シニョリンの構造データは、日米欧で協調して運営されている国際的公共データベースであるタンパク質構造データバンク(PDB)に登録されている(登録番号:1UAO)。なお、PDBに登録されたタンパク質の中で、固有の立体構造と構造転移の協同性が確かめられているのはシニョリンが最小である。
タンパク質の自律要素仮説の検証に向けて、引き続き安定な短鎖ペプチドの設計を進める。また、コンピュータによるペプチドの構造安定化技術の高度化を図り、阻害剤やワクチン等の医薬原料への応用を検討することで、産業分野への波及拡大を目指す。