独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)浅島 誠 フェローと幹細胞工学研究センター【研究センター長 浅島 誠】幹細胞制御研究チーム 桑原 知子 研究員は、筑波大学 人間総合科学研究科 征矢 英昭 教授らと共同で、老化に伴って脳内の
神経新生が減衰していく仕組みをマウスを用いて解明し、中心となる因子である
Wnt3(ウィント3)とその因子が担っている役割をつきとめました。
「学習」と「記憶」の能力を司る脳内の海馬という部分には神経幹細胞が存在し、大人になっても新しい神経細胞がたえず作られています。海馬で神経細胞の一番下の層を形成している細胞は、アストロサイト細胞とよばれ、Wnt3という因子を産生して、多様性のある神経細胞を産み出す機構(神経新生)をコントロールする重要な役割があります。
老化に伴って海馬の神経幹細胞の数は顕著に減少し、同時に多様な神経細胞群を産み出す能力も減衰していきます。今回、神経幹細胞を支えるアストロサイト細胞は、老化した脳内でも運動などの生体の外から与える刺激によって、Wnt3産生量を増加させ、その結果として神経新生機能が増すことが分かりました。
この成果は、実験生物学に関する米国の科学誌「FASEB Journal」に掲載されます。
 |
|
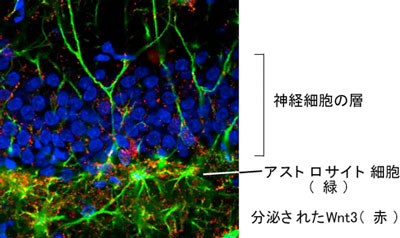
図 海馬における神経新生。アストロサイト細胞が分泌するWnt3により神経幹細胞から神経細胞が産み出される。
|
人間の脳内にある海馬では、生涯にわたり新しい神経細胞が産み出されています(神経新生)。しかしその頻度は年齢とともに減少し、ストレスや疾患など個人がおかれた環境によっても大きく変化します。アルツハイマー病、認知症、うつ病等の神経変性疾患や精神疾患では、海馬の神経新生現象がさらに顕著に低下します。これは、海馬の「神経新生」現象が、外的刺激や個人の生体環境によって容易に変化し得る分子メカニズムで調節されていることを示しています。この「外的刺激」には、海馬での新しい神経細胞のネットワーク形成を増加させるもの(例えば、 運動、玩具を配置するなどの豊かな生育環境作りなど)もあれば、減少させるもの(例えば、ストレス、疾患、老化など)もあり、それらに応答して数多くの遺伝子の発現様式が多様に変化することが分かってきました。
多くの現代人を悩ませる、神経疾患・精神疾患の効果的な創薬・医療の開発には、「老化」と「脳の細胞機能」を結びつける分子メカニズムの解明が必要とされています。そのためには、神経幹細胞の分化制御機構のみでなく、幹細胞を取り巻く細胞が支えている機能や役割を解析することも重要です。これらを通じて、全く新たな治療法や、従来よりも有効な創薬の標的を見つけ出すことが期待されています。
産総研では、脳内にある神経幹細胞を解析し、アルツハイマー病やうつ病の医療・創薬開発に役立てる研究を行っています。海馬の神経新生とアルツハイマー病やうつ病といった神経疾患には密接な関係があることがこれまでに分かっていますが、どの分子がどの細胞で作用すると病気に結びつくのかという仕組みについては、ほとんどが明らかになっていません。幹細胞工学研究センターではこれまでに、アストロサイト細胞の産生するWnt3が神経新生の起点になること、すなわちWnt3の
シグナル伝達によって、神経分化に必要となるNeuroD1遺伝子や、神経細胞の多様化を産み出す
レトロトランスポゾンの遺伝子が活性化することを見出しています(
2009年10月8日「主な研究成果」)。
前回は「神経新生」の基本となるメカニズムを明らかにしたわけですが、今回の研究では、疾患や老化といった個体の現象と、脳内の神経幹細胞やその周囲の細胞がどのように関係しているのか、それぞれについて詳細に調べました。また、その研究の過程で、機能が損なわれた細胞を、再び活性化させるには、どの分子が中心として働くのかを検証するために、マウスを用いて「運動」効果を調べる実験も行いました。筑波大学では、脳の認知機能を増強するような運動処方の開発を目指す研究をしており、産総研幹細胞工学研究センターでは、神経幹細胞を用いてその分子基盤について解析しました。
本研究は、独立行政法人 日本学術振興会科学研究費補助金(若手研究B、基盤研究A)の支援を受けて行ったものです。
老齢マウスの海馬と若齢マウスの海馬から「神経幹細胞」をそれぞれ樹立・培養したところ、試験管内の独立した実験環境では、神経幹細胞の増殖能力や
遺伝子発現プロファイルに大きな差異がないことが分かりました。これは、神経幹細胞を培養する過程で加える栄養因子の効果によるものと考えられます。これは、外から加える因子によって老化した神経幹細胞でも、若い神経幹細胞と同じような状態へと導けることを示しています。つまり、神経幹細胞自体の潜在的な神経新生能力そのものは、老化によっても根本的に損なわれていない可能性を示唆しています。
対照的に、老齢マウスの海馬と若齢マウスの海馬から「アストロサイト細胞」をそれぞれ樹立・培養すると、老齢マウスの海馬「アストロサイト細胞」培養系では、若齢マウスの海馬「アストロサイト細胞」に比べるとWnt3産生能力が30分の1程度と大幅に減少していることが分かりました(図1)。
 |
|
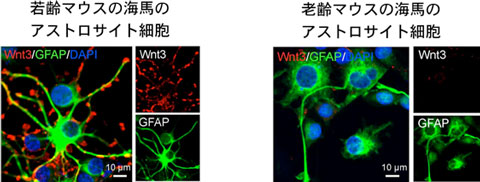
図1 若齢マウスの海馬より抽出し、培養したアストロサイト細胞(左)。
老齢マウスの海馬より抽出・培養したアストロサイト細胞(右)。
アストロサイト細胞のマーカーであるGFAP(緑;抗体染色)はどちらも同様に発現している。
若齢マウスの海馬アストロサイト細胞(左)からは、Wnt3(赤;抗体染色)が盛んに産生されているが、老齢マウスの海馬アストロサイト細胞(右)からは、Wnt3の分泌がほとんど観察されない。
|
さらに、老齢マウス群に、ストレスを感じさせない程度の運動(ランニング)を短期間行わせると、海馬アストロサイト細胞のWnt3産生能が大幅に増加しました。この分泌されたWnt3の増加に伴って、それを受け取る神経幹細胞内の神経分化に必要な遺伝子が活性化され、神経新生機能が増すこと、すなわち海馬で新しく産み出される神経細胞の数が増加することが分かりました。
海馬で新しく神経細胞が作られる過程には、「神経細胞の多様性(特異性の獲得)」を引き起こすメカニズムが備わっています。海馬の多様な神経細胞では、同じ神経特異的遺伝子でも、それぞれ微妙に異なった発現プロファイルを持っています。細胞内で発現する各遺伝子の量を調節することを「クロマチン制御」といいますが、海馬の神経細胞のクロマチン制御には、他の細胞と違うユニークな特徴があります。それは、ゲノムのノンコーディング領域に含まれるレトロトランスポゾンが、様々な遺伝子の近くで活性化されることでクロマチン制御に違いが生じることで、これによって神経細胞の多様性が産まれます。この様々な遺伝子の発現を調節している仕組みが、「運動(ランニング)」といった個体への刺激によって、どのように変化するのか調べました。すると、新しく産まれた神経細胞内のレトロトランスポゾンのクロマチン制御の状態が、アストロサイト細胞が産生するWnt3の量に、敏感に依存していることが分かりました(図2)。
 |
|
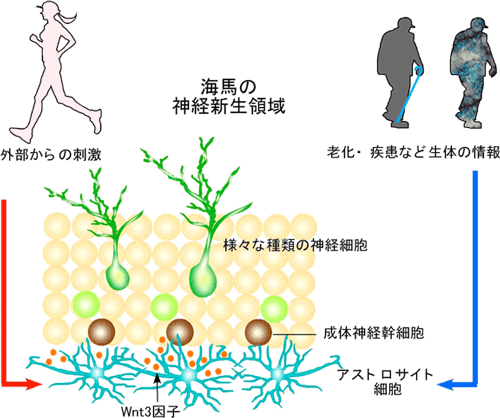
図2 個体の情報を神経幹細胞へ伝える因子(Wnt3;オレンジ)。
神経幹細胞内の遺伝子発現や、神経細胞の多様性を産み出す分子メカニズム自体は変わらないが、アストロサイト細胞のWnt3産生能は個体の状態に大きく依存する。
|
これまで、老化によって脳内で新しい神経が作られなくなってくるのは、元となる「神経幹細胞」の数が減ってしまうことが第一の原因と考えられてきました。今回、「神経幹細胞」ではなくアストロサイト細胞に神経新生を大きく左右する因子があり、それが「神経幹細胞」の若返りにもつながる役割を持っていることを明らかにしました。脳内の神経新生を上昇させる外的刺激(運動)と、減少させる状況(老化、疾患)との双方の変化に即して、広範なゲノム応答をオン/オフする分子機構が見つかってきたことは、今後の神経・精神疾患の創薬・医療への新たなアプローチの基盤となる知見が確かめられたと考えられます。
老化や様々な神経疾患の状態を左右する、幹細胞の周囲の細胞の役割を今後さらに解析し、診断に有効な新しい分子マーカーの検出方法を探索する予定です。幹細胞自体を操作しなくても、幹細胞を支えている細胞群の活性化を促すような創薬開発や新規医療技術の開発など、今後の多様な産業に応用させていきたいと考えています。
独立行政法人 産業技術総合研究所
幹細胞工学研究センター 幹細胞制御研究チーム 研究員
桑原 知子 E-mail:
フェロー 兼 幹細胞工学研究センター 研究センター長
浅島 誠 E-mail: