独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)健康工学研究部門【研究部門長 吉田 康一】、組織・再生工学研究グループ 弓場 俊輔 研究グループ長、大串 始 招聘研究員、小田 泰昭らは、ヒトの親知らず(歯胚)由来の間葉系細胞から従来の皮膚細胞を用いた場合に比べ100倍以上の効率でiPS細胞を樹立することに成功した。
iPS細胞は、高い増殖能力とさまざまな細胞へと分化する能力を持っていることから、再生医療への応用が期待されている。iPS細胞の樹立には、主にOCT3/4、 SOX2、 KLF4、 c-MYCの4遺伝子を皮膚細胞などに導入するのが一般的であるが、c-MYCは細胞のガン化を引き起こす可能性があると報告されている。c-MYCを除いた3遺伝子でもiPS細胞の樹立は可能であるが、効率が著しく低下するのが大きな課題であった。
今回、産総研では歯胚由来間葉系細胞を単一細胞まで解離して、個々の細胞を独立に増殖させた歯胚クローンを作製しOCT3/4、 SOX2、 KLF4の3遺伝子を導入してiPS細胞樹立を行ったところ、皮膚細胞より100倍以上効率よくiPS細胞を樹立できる有用なクローンが存在することを証明した(図1)。歯胚クローンから樹立したiPS細胞は、皮膚細胞から樹立したものと同様に、高い増殖能や多分化能をもっていた。これまで抜歯時に廃棄されていた親知らずの歯胚組織が、高効率でiPS細胞樹立に利用できることから、再生医療への応用に貢献できると期待される。
この技術の詳細は、2010年9月17日付の米国のJournal of Biological Chemistry誌(J. Biol. Chem. 285, 29270 (2010))に掲載され、papers of the weekとして注目された(http://www.jbc.org/content/285/38.toc)。さらに、出版元であるAmerican Society for Biochemistry and Molecular Biologyのウェブサイトでも特集記事として取り上げられた(http://www.asbmb.org/News.aspx?id=9418)。
 |
|
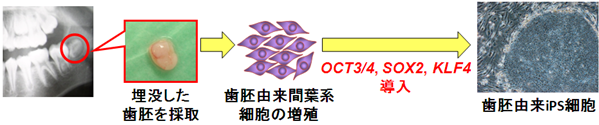
図1 歯胚由来間葉系細胞の増殖とiPS細胞樹立の概略図
|
同意の得られた提供者から、生えてくる前の埋没した歯胚を採取・培養して歯胚由来間葉系細胞を増殖させた。この歯胚由来間葉系細胞を数年間保存し、一部を解凍してOCT3/4、SOX2、KLF4の3遺伝子を導入してiPS細胞を樹立した。
2007年に京都大学の山中伸弥教授らによって報告されたヒト人工多能性幹細胞(iPS細胞)の樹立は、幹細胞を利用した再生医療の実現化に向けて大きな飛躍をもたらした。ヒトの皮膚などの細胞に、
OCT3/4、
SOX2、
KLF4、
c-MYCの4つの遺伝子を導入することで、体を構成する全ての細胞へと分化できる胚性幹細胞(ES細胞)とほぼ同等の細胞が作り出せたのである。原因不明の難病やさまざまな疾患の患者の細胞からiPS細胞を作り出すことで、患者個人を直接対象とした解析が困難な病気の詳細なメカニズム解明や、新しい薬の開発、iPS細胞から分化誘導した細胞を用いた細胞移植治療などへの応用が期待されている。
4遺伝子のうち、c-MYCはガン化を招く懸念があると報告され、その後、c-MYCを除く3遺伝子でもiPS細胞を樹立できると報告されたが、その効率は著しく低下してしまった。そのため、ガン化を引き起こすc-MYC遺伝子を用いることなく、効率のよいiPS細胞樹立方法が求められている。
性別や年齢を問わず、採取が容易である組織や治療などで捨てられる組織からiPS細胞を樹立することができれば、iPS細胞樹立が容易になるだけでなく、細胞を凍結保存して細胞バンク化することも可能になる。さらに、HLAのタイプを一致させれば第三者への他家移植も可能となると期待されている。
iPS細胞樹立の効率は、元となる細胞源(皮膚や血液等)によって大きく異なることが知られており細胞源の選択が重要になる。産総研は、歯科医で抜歯され医療廃棄物として処分されている親知らず(歯胚)に注目し、提供者の同意の下に得られ、産総研で数年間凍結保存されていたヒトの親知らず(歯胚)由来間葉系細胞に、
OCT3/4、
SOX2、
KLF4の3遺伝子を導入することによりiPS細胞を樹立できることを2008年に見出した。(2008年8月25日主な研究成果)しかし、歯胚由来間葉系細胞は歯の発生段階のさまざまな細胞からなる雑多な細胞の集合であるため、詳細な解析を行うことが困難であった。今回、私たちは提供者から得られた歯胚由来間葉系細胞を単一細胞にまで解離して、個々の細胞を独立に増殖させた歯胚クローンを作製し、クローンからのiPS細胞樹立を試みた。
なお、この研究は文部科学省 再生医療の実現化プロジェクト【プログラムディレクター 国立精神・神経センター神経研究所 高坂 新一】 幹細胞治療開発領域における研究課題 「重度先天性骨代謝疾患に対する遺伝子改変間葉系幹細胞移植治療法の開発」【研究代表者 産総研 健康工学研究部門 大串 始 招聘研究員】の一環として行われ、得られたバイオインフォマティクス解析結果は、産総研 生命情報工学研究センター【研究センター長 浅井 潔】生体ネットワーク研究チーム 堀本 勝久 研究チーム長らとの共同成果である。
数年間冷凍保存されていた3人の提供者(10、 13、 16歳)の歯胚由来間葉系細胞を増殖させ、これにレトロウイルスベクターを用いてOCT3/4、 SOX2、 KLF4の3遺伝子を導入した。5日間培養した後に、細胞を剥離してフィーダー細胞の上に播種し、ヒトiPS細胞用の培地で約25日間培養を行ったところ、ヒトES細胞やiPS細胞とよく似た形態の細胞塊が得られた(図2A)。iPS細胞樹立効率を比較したところ、10歳女性由来の歯胚由来間葉系細胞からの樹立が最も効率が高かった(図2B)。
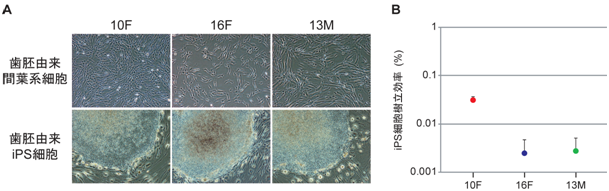 |
図2A 3人の提供者からの歯胚由来間葉系からiPS細胞を樹立
上段:10歳女性(10F)、16歳女性(16F)、13歳男性(13M)由来の歯胚間葉系細胞の形態
下段:それぞれの歯胚由来間葉系細胞から樹立したiPS細胞。左上の大きな細胞塊がiPS細胞で、その周囲に見られる紡錘状の細胞はフィーダー細胞
図2B 3人の歯胚由来間葉系からiPS細胞樹立の効率比較
3人の提供者の歯胚由来間葉系細胞からiPS細胞の樹立した際の効率を対数グラフで表した
|
歯胚由来間葉系細胞は歯の発生段階の細胞であるため、さまざまな種類の細胞が混在している。そこで、より詳細な解析を行うために、歯胚由来間葉系細胞を単一細胞にまで解離し、個々の細胞を独立に増殖させて5株の細胞株(歯胚クローン)を作製した(10F-15、 10F-5、 10F-8、 10F-101、 10F-107)。これら5株の歯胚クローンとヒトの皮膚細胞(HDF: Human dermal fibroblast )を用いて、上述の方法でiPS細胞を樹立したところ、ヒトES細胞やiPS細胞の指標であるアルカリフォスファターゼ(ALP)活性をもつことが確認された(図3A)。また、10F-15、 10F-5、 10F-8の3株は、HDFより100倍以上も樹立効率が高いことが明らかとなった(図3B)。一方、10F-101はHDFより樹立効率が数倍高く、10F-107からは全くiPS細胞が樹立できなかった。このように、歯胚クローン間でもiPS細胞の樹立効率に大きな違いがあった。
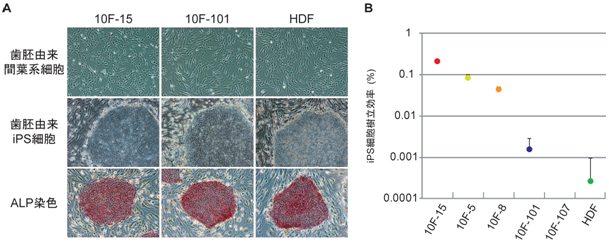 |
図3A 歯胚クローンおよび皮膚細胞からのiPS細胞樹立とALP染色
上段:歯胚クローン(10F-15および10F-101)とヒト皮膚細胞(HDF)の細胞の形態。
中段:それぞれの細胞から樹立したiPS細胞の形態。右下の細胞塊がiPS細胞で、 周囲の細胞はフィーダー細胞。
下段:それぞれのiPS細胞をアルカリフォスファターゼ(ALP)の活性を指標に染色した図。
iPS細胞はALP活性を持つため赤色に染まるが、周囲のフィーダー細胞はALP活性を 持たないため染まらない。
図3B 歯胚クローンおよび皮膚細胞からのiPS細胞樹立効率の比較
5株の歯胚クローンとHDFからiPS細胞の樹立した際の効率を対数グラフで表した。10F-15、10F-5、 10F-8の歯胚クローンでは、HDFに比べ、iPS細胞の樹立効率が100倍以上高いことが分かる。
|
iPS細胞の樹立効率に影響する遺伝子を探索するために、高効率でiPS細胞が樹立できる歯胚クローン(10F-15、 10F-5、 10F-8)と、低効率の歯胚クローン(10F-101、 10F-107)および皮膚細胞間で、網羅的な遺伝子の解析を行った。その結果、iPS細胞の樹立効率が高い歯胚クローンではPAXIP1という遺伝子がより強く働いていることが分かった。樹立した歯胚クローン由来のiPS細胞を未分化ヒトES細胞やiPS細胞の指標であるSSEA-3、 SSEA-4、 TRA-1-60、 TRA-1-81、 OCT3/4、 NANOG抗体で免疫染色すると、いずれも陽性であることが確認された(図4)。
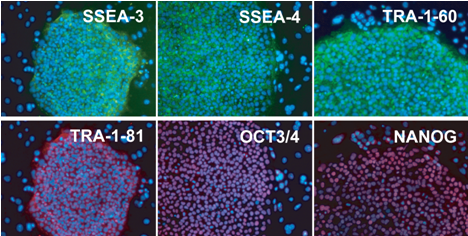 |
図4 歯胚由来間葉系細胞からのiPS細胞の未分化指標の確認
免疫染色法により、それぞれの抗体を用いて染色を行った。樹立した歯胚由来間葉系細胞からのiPS細胞は、未分化ES細胞やiPS細胞の指標であるSSEA-3、 SSEA-4、 TRA-1-60(緑色の部分)、あるいはTRA-1-81、 OCT3/4、 NANOG(赤色の部分)で染色すると、これら全てが陽性であることから未分化なヒトiPS細胞であることがわかる。青色の部分は細胞の核を示している。
|
ES細胞やiPS細胞の大きな特徴の1つは、さまざまな細胞へと変化することのできる分化多能性である。歯胚クローン由来のiPS細胞の分化多能性を検証するために、浮遊培養を介した分化誘導を行った。iPS細胞を非接着性の培養皿で8日間ほど培養すると、球体状の胚様体が形成される(図5A)。次に、この胚様体を接着性の培養皿でさらに8日間ほど培養すると、胚様体はさまざまな細胞へと自発的に分化した。歯胚クローン由来iPS細胞の胚様体は生体外において、SOX17陽性の内胚葉系の細胞(図5B)、α-smooth muscle actin陽性の中胚葉系の細胞(図5C)、βIII-tubulin陽性の外胚葉系の細胞(図5D)へと分化できることが明らかとなった。さらに、免疫不全動物へ歯胚クローン由来iPS細胞を移植すると、生体内においても内胚葉、中胚葉、外胚葉へと分化できることが明らかとなった。
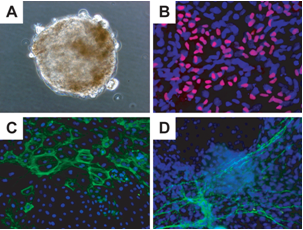 |
図5 歯胚由来間葉系細胞からのiPS細胞の生体外での多分化能を検証
(A) 歯胚由来間葉系細胞からのiPS細胞を浮遊培養して得られた胚様体
(B)(A)の胚様体を接着して培養することで得られたSOX17陽性(赤色部分)の細胞。>青色の部分は細胞の核を示している。
(C) (A)の胚様体を接着して培養することで得られたα-smooth muscle actin陽性(緑色部分)の細胞。青色の部分は細胞の核を示している。
(D) (A)の胚様体を接着して培養することで得られたβIII-tubulin陽性(緑色部分)の細胞。 青色の部分は細胞の核を示している。
|
以上のように、歯胚由来間葉系細胞の中には皮膚細胞より100倍以上効率よくiPS細胞を樹立できる有用な細胞が存在することが分かった。歯胚クローンから樹立したiPS細胞は、皮膚細胞から樹立したものと同様に、高い増殖能や多分化能を示した。これまで、抜歯時に医療廃棄物として処分されていた親知らずの歯胚組織から、ガン化を引き起こすc-MYC遺伝子を使用しなくても非常に高効率でiPS細胞を樹立できるため、親知らずの歯胚はiPS細胞樹立の細胞源として有用であり、再生医療へ幅広く利用できるものと期待される。