独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)ユビキタスエネルギー研究部門【研究部門長 小林 哲彦】蓄電デバイス研究グループ【研究グループ長 辰巳 国昭】田渕 光春 主任研究員、竹内 友成 主任研究員、先進製造プロセス研究部門【研究部門長 村山 宣光】結晶機能制御研究グループ 秋本 順二 研究グループ長と、株式会社 田中化学研究所【代表取締役 田中 保】(以下「田中化学」という)研究開発部解析チーム 今泉 純一 チームリーダーは、共同で、酸化物中全遷移金属量の20 %に資源的に豊富で安価な鉄を用いた2種類のリチウムイオン二次電池用新規コバルトフリー酸化物正極材料(Li1+x(Fe0.2Ni0.4Mn0.4)1-xO2とLi1+x(Fe0.2Ni0.2Mn0.6)1-xO2)を開発した。
これらは希少金属であるコバルトを含まず、また、鉄を多く含むにもかかわらず放電電圧は3.5-3.7 Vと以前に産総研が開発した酸化物正極材料(Li1+x(Fe0.5Mn0.5)1-xO2、放電電圧3.0 V)より大幅に改善され、既存の正極材料であるLiNi1/3Mn1/3Co1/3O2やLiNi1/2Mn1/2O2の放電電圧4.0 Vに近づいた。これまで資源量や価格面で有利であるが酸化物正極材料への導入は困難とされてきた鉄が活用でき、電気自動車、ハイブリッド車等の電動車両用リチウムイオン二次電池の省資源化・低コスト化につながるものと期待される。
なお、本技術の詳細は、2009年11月30日~12月02日に国立京都国際会館にて開催される第50回電池討論会で発表される。本成果は、独立行政法人 新エネルギー・産業技術総合開発機構(NEDO)の委託研究「次世代自動車用高性能蓄電システム技術開発(Li-EADプロジェクト)―高容量・低コスト新規酸化物正極材料の研究開発―(平成19年度から21年度)」の一環で得られたものである。
 |
|
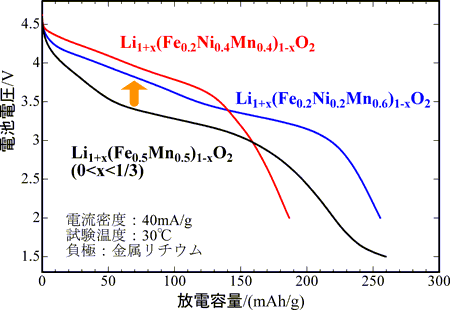
図1 今回開発した正極材料(赤、青)と以前に開発した正極材料(黒)の5 V充電後の初期放電曲線
|
最近、環境問題、省エネルギーに関する意識の高まりから、電気自動車やハイブリッド車に代表される電動車両が注目されている。電動車両用の電源には、主にニッケル-水素電池が用いられているが、電池重量や体積あたりに貯蔵・放出できる電気エネルギー(エネルギー密度)に優れるリチウムイオン二次電池の採用が始まっている。リチウムイオン二次電池は、携帯電話、ノートPC用として日本の電池メーカーを中心に研究開発や生産が行われてきたことから、諸外国での電池生産が盛んになってきている現在も、技術的には日本が優位に立っている。
車載用リチウムイオン二次電池の普及には、安全性確保はもちろん、一層の高性能化と低コスト化が求められる。特に低コスト化のためには正極、負極、電解質などの材料をより安価なものに代替する必要があり、中でもリチウム遷移金属酸化物である正極材料は、多くの材料で希少金属であるコバルトが使用され、電池の構成材料の中でも最も高価なものの一つである。そのため、現行のリチウムイオン二次電池に対する性能の低下を抑えながら、原材料(酸化物)価格換算でコバルトの約1/10の鉄、約1/8のマンガン、約1/4のチタン等の安価で資源的に豊富な金属元素からなる正極材料へと代替することが求められている。しかしながら安価で高性能な代替正極材料として決定的なものは見いだされておらず、その開発が強く望まれている。
産総研は、安価で毒性が低く資源的に豊富な、鉄やチタンをリチウムイオン二次電池の酸化物正極材料に利用するため、鉄やチタンを含むマンガン酸化物の研究を行ってきている。(2004年10月21日、2004年11月22日、2006年11月6日プレスリリース)鉄含有マンガン酸化物に関しては分析電子顕微鏡等を用いた充放電機構解明も行っており、鉄の働きや、試料の化学組成、作製条件と充放電容量の関係などを見いだしてきている。(2008年8月18日プレスリリース)
これまで酸化物正極材料に鉄やチタンが利用されてこなかったのは、これらの元素を含む材料の充放電特性が、製造プロセス依存性が高く、固相反応等の通常の製造プロセスでは、良好な充放電特性を有するものが得られていなかったためである。特に粒子径制御は重要で、粒子径が小さいものほど放電容量が大きくなることがわかってきた。産総研は2007年から共沈物製造プロセスに豊富なノウハウをもつ田中化学と共沈工程などの合成プロセスを工夫することで鉄やチタンをマンガン酸化物に固溶させた新規酸化物正極材料の共同開発を行ってきている。
産総研でこれまで開発してきた酸化物正極材料は鉄、マンガン、チタンなどを用いており、素材コストや資源の豊富さの点から有利であるが、平均放電電圧が3.0 Vと低く、既存の正極材料であるLiNi1/3Mn1/3Co1/3O2やLiNi1/2Mn1/2O2の平均放電電圧4.0 Vとの差が大きい。そこで今回、平均放電電圧向上のために、電池分野で比較的多く用いられているニッケルを、鉄含有マンガン酸リチウム(Li2MnO3)系に導入した。ニッケルは、原材料(酸化物)価格換算でコバルトの約1/2~1/3に相当するコバルトより安価な元素である。ニッケル量は全遷移金属あたり40 %以下になるように、また鉄を全遷移金属量あたり20 %以上含むように、以下の2種の正極材料を作製した。
Li1+x(Fe0.2Ni0.2Mn0.6)1-xO2 (0 Li1+x(Fe0.2Ni0.4Mn0.4)1-xO2 (0
材料Aは、これまで開発してきた鉄含有Li2MnO3系(Li1+x(FeyMn1-y)1-xO2固溶体(02MnO3に対する電気化学的活性化元素として導入したものである。材料Bは、母体となる正極材料を3 V級のLi2MnO3から4V級のLiNi1/2Mn1/2O2に変更して鉄を導入したものである。
正極材料の製造は、産総研で開発した共沈-水熱-焼成法を基本とした。
(1)共沈工程:所定の硝酸鉄、硝酸ニッケル、塩化マンガンの混合水溶液を冷却後、エタノールを加えて不凍化した水酸化リチウム水溶液に滴下する。得られた沈殿を室温で湿式空気酸化して、鉄-ニッケル-マンガン共沈物を作製する。
(2)水熱工程:鉄-ニッケル-マンガン共沈物を、水酸化リチウム、水酸化カリウム、塩素酸カリウムを含む蒸留水に投入し、オートクレーブ内(温度220 ℃、圧力約2 MPa)で48時間水熱処理を行う。
(3)焼成工程:水熱処理した共沈物を水酸化リチウム溶液に分散後、蒸発乾固、粉砕する。電気炉により700 ℃または750 ℃、大気または窒素気流中で20時間焼成し、生成物を粉砕、水洗、ろ過、乾燥して正極材料を製造した。
この方法により、最も重要な、遷移金属イオンの均一な分布を確保しつつ、比較的低い温度で焼成を行うことが可能となり、結果として高温焼成に伴う粒成長により充放電特性が大幅に劣化する鉄の活用が可能となった。特に共沈工程では、沈殿形成後の湿式空気酸化が高品質な試料の安定製造のための鍵の一つであり、試料全体で均一に行われるように酸化工程を改良した。また水熱処理時間を長時間にすることで、さらに均質な試料となるようにした。さらにこの方法を用いることにより材料A、Bともに既存の4 V級正極材料であるLiNi1/3Mn1/3Co1/3O2やLiNi1/2Mn1/2O2と同様の層状岩塩型Li2MnO3構造をとることができるようになった。
材料A(窒素気流中750℃で焼成)の充放電特性のうち5 V充電後の放電曲線を図1に示す。初期充電容量349 mAh/g、初期放電容量は255 mAh/g、初期平均放電電圧は3.46 Vであった。充放電容量は表1に示すように4 V級の既存正極(LiNi1/3Mn1/3Co1/3O2)の容量220 mAh/g(文献値)と同程度である。また放電電圧も従来開発品(Li1+x(Fe0.5Mn0.5)1-xO2)より0.5 V高い。材料B(窒素気流中750 ℃で焼成)の充放電特性のうち5 V充電後の放電曲線を図1に示す。初期充電容量261 mAh/g、初期放電容量は187 mAh/g、初期平均放電電圧は3.67 Vであり、充放電容量は表1に示すように4 V級の既存正極(LiNi1/2Mn1/2O2)の容量200 mAh/g(文献値)と同程度である。また放電電圧も従来開発品より0.7 V高い。これらの鉄を含む正極材料は、平均放電電圧が若干低いだけで、既存の正極材料と同様の充放電特性を示し、また、20サイクル経過後の充放電曲線の形状が相似形を維持していること、20サイクル後も、材料Aで初期放電容量の76 %、材料Bで65 %を維持していることから、車載用のリチウム二次電池の正極として期待される。
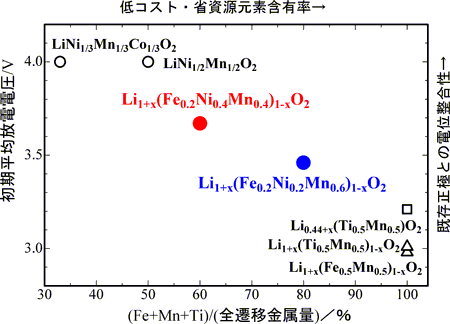
今回開発した正極材料系と他の正極材料の遷移金属組成と平均放電電圧を比較したものを図2に示す。横軸は全遷移金属量に対する鉄、マンガン、チタンの割合(全遷移金属量からコバルトとニッケルの含有量を差し引いた値)であり、低コスト・省資源元素の含有率に対応する。一方、縦軸は初期平均放電電圧であり、4 V級の既存正極との電位整合性に対応する。
今回開発した正極材料は、産総研が従来開発した遷移金属が鉄、マンガン、チタンだけの3 V級正極材料(従来開発品)よりも放電電圧が0.5V以上高く、より既存正極に近い。一方でニッケルを含むことは低コスト化の阻害要因になるが、既存正極に比べニッケル量は同程度でコバルトを含まず、資源的に最も豊富で安価な鉄を含むため、既存正極の代替材料となる可能性が高い。4 V級の既存正極から今回開発した3.5-3.7 V級に代替することにより、正極材料の低コスト化、省資源化を図りつつ、従来開発品に比較して鉄を含む酸化物正極の早期の実用化が期待できる。
 |
|
図2 今回開発した正極材料の初期放電平均電圧と全遷移金属量に占める鉄、マンガンおよびチタン量の割合の関係と2種の既存正極材料や従来産総研が開発した3種の正極材料との比較。
|
今後は、安定した試料作製を可能とし、2010年の早い時期に電池メーカー等産業界へサンプル提供できるようにしたい。また、さらに鉄含有量の多い試料でも良好な充放電特性が得られるように酸化物の組成や作製条件の研究開発を続ける。