国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)人間情報研究部門【研究部門長 持丸 正明】システム脳科学研究グループ 長坂 和明 技術研修員(日本学術振興会 特別研究員・筑波大学大学院人間総合科学研究科 博士後期課程学生)、高島 一郎 研究グループ長、松田 圭司 主任研究員、肥後 範行 主任研究員は、脳卒中後に生じる痛みである脳卒中後疼痛のメカニズムの解明や、脳卒中後疼痛のために開発した治療法を評価するためのモデル動物を開発した。
今回、モデル動物であるサルの脳で、皮膚に触れたときの感覚の情報(体性感覚情報)を中継する視床の後外側腹側核に局所的な脳出血を作成し、感覚刺激に対する逃避行動を調べた。脳損傷が安定してから数週間経過した後には、脳損傷前は逃げることがなかった軽い触覚や温度を与えたときにも逃げる様子が見られたことから、アロディニアと呼ばれる症状が生じたと考えられた。これまで、げっ歯類をモデル動物とした研究は複数あったが、いずれもアロディニアの発症に至る時間経過がヒトと異なっていた。今回の研究はヒトに近い脳を持つサルをモデル動物としており、また実際にヒトの患者に近い病態が得られたため、世界で最もヒトの病態に近い脳卒中後疼痛モデル動物であるといえる。このモデルを用いることで、脳卒中後疼痛を引き起こすと考えられている不適切な脳の変化の解明や、この病気を根治する治療法の開発につながる可能性がある。
なお、今回の結果は、2017年9月4日に国際科学誌Scientific Reportsにオンライン掲載された。
 |
|
脳卒中後疼痛のメカニズムの解明や、治療効果の評価につながる可能性のあるモデル動物 |
脳卒中をはじめとする脳の損傷は、高齢化が進む日本では深刻な社会問題となる。脳に損傷を受けると後遺症をもたらすことが多く、リハビリテーションによる回復が必要となる。しかし、脳卒中によって、視床という脳の領域に損傷を受けると、脳卒中後疼痛という痛みが生じることがあり、痛みが永続的に続くこともあるため日常生活の動作やリハビリテーションが著しく阻害される。本来、痛みは身体の異常を知らせる生理的反応であるが、脳卒中後疼痛は"痛みそのものが病気"という特殊な痛みである。脳卒中後疼痛では、軽い感覚刺激でも痛みを感じるアロディニアという症状がしばしばみられる。治療技術が確立しておらず、従来の鎮痛薬もあまり効果がないことから、脳卒中後疼痛は人間が直面する"最悪の痛み"と呼ばれることもある。
脳卒中後疼痛は脳卒中の発症後、数週間から数か月経過後に出現するため、この間の脳の変化が痛みを生み出すと考えられてきた。しかし、その変化の実態は解明されておらず、治療技術の開発も進んでいない。ある疾病に対する治療技術の開発には、その症状を再現できるモデル動物の確立が不可欠であり、脳卒中後疼痛についても適切なモデル動物が求められていた。
産総研は、モデル動物を用いた脳損傷後の機能回復メカニズムの研究に強みを持ち、脳機能の回復を支援するリハビリテーション技術に関する研究開発を行ってきた。脳卒中後疼痛はリハビリテーションを阻害する大きな要因であるため、これまでに培った局所脳損傷作成および行動評価技術を活用して脳卒中後疼痛の問題に取り組んだ。
なお、本成果は、独立行政法人 日本学術振興会 科学研究費補助金 特別研究員奨励費(平成29~30年度)、基盤研究C(25351004:平成25~27年度、16K01489:平成28~30年度)、文部科学省 科学研究費補助金 新学術領域研究「身体性システム」(17H05917:平成29~30年度)、戦略的創造研究推進事業さきがけ「脳情報の解読と制御」(平成21~24年度)による支援と国立研究開発法人 新エネルギー・産業技術総合開発機構「次世代人工知能・ロボット中核技術開発」(平成28~31年度)の委託業務の結果得られた。
今回、核磁気共鳴画像法(MRI)により、ヒトに近い脳を持つサルの脳の構造を計測した後、視床に電極を刺してニューロンの応答を計測した。視床のなかでも後外側腹側核は、体性感覚の中継機能を担うため、体性感覚への刺激に応じてニューロン活動が増加する。そこで、刷毛でサルの上肢に体性感覚刺激を与えたときのニューロン活動の増加を指標として後外側腹側核を同定した。同定した視床後外側腹側核に血管壁を破壊する酵素を注入して局所的に脳出血させた。
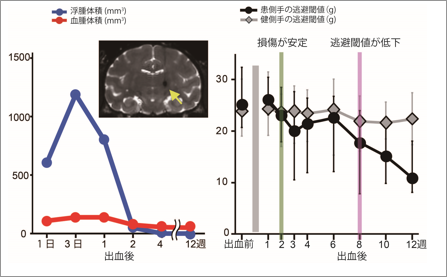
その後のMRIによる計測により、出血によりできた血腫や浮腫の体積は、損傷後3日~1週間後は増加したが、2週間後には減少した(図1左)。この時、モデル動物に明らかな運動麻痺や認知機能異常は見られなかった。そこで、動物の感覚応答の変化を計測するため、痛みを生じない程度の弱い機械的体性感覚刺激を上肢に与え、自由に逃避できる状況で逃避しはじめる刺激の閾値を計測した。その結果、出血後8週以降では出血前と比べて、より弱い刺激で逃避しはじめ(図1右)、脳損傷前は痛みを感じることがなかった軽い刺激に対しても痛みを感じていることが示された。同様に、脳損傷前は痛みを感じることがない程度の低い温度の刺激を上肢に与えた場合にも、出血後4週以降には逃避するようになった。これらの結果から、視床後外側腹側核の損傷が安定して数週間経過した後に、アロディニアのような症状が生じていると考えられる。これは、脳卒中患者の脳卒中後疼痛の病態と類似している。
これまで、げっ歯類を用いた視床出血後の感覚変化の研究では、出血後1週間以内に、より弱い刺激で逃避する行動が始まり、ヒトの病態とは異なっていた。今回確立したモデル動物はヒトに近い脳を持つサルを用い、また、体性感覚応答を示す後外側腹側核領域に局所的な脳出血を誘発する手法も新しい。実際にヒト患者に近い病態が得られたため、脳卒中後疼痛を引き起こすメカニズムの解明や、脳卒中後疼痛の治療の効果の評価に適したモデル動物と考えられる。
 |
|
図1 視床部分を出血させた後の損傷体積と、逃避しはじめる感覚への刺激の閾値の変化 |
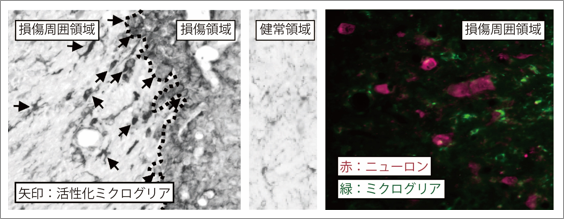
さらに、脳卒中後疼痛の背景にある脳の変化を解明する第一歩として、疼痛の発症との関連が示唆されているミクログリアの変化を調べた。損傷周囲領域では、損傷を受けていない健常領域と比べて、ニューロン近くに活性化したミクログリアが集積していることが確認できた(図2)。活性化したミクログリアの顕著な増加はげっ歯類を用いたモデルよりも長く続き、脳出血の3ヶ月後でも見られた。この結果から、本モデルでは、脳卒中後疼痛患者と同様の時間経過で脳に不適切な変化が生じていると考えられる。
 |
|
図2 損傷周囲におけるミクログリアの活性化 |
今後は、開発したモデル動物を用いて脳卒中後疼痛に関わる変化を同定する。また、痛みに関わる脳活動を評価する手法を開発しているので、開発したモデル動物に対して痛みに関わる脳活動を評価する手法を適用することで、脳卒中後疼痛に関わる脳活動の変化を解明し、脳卒中後疼痛の治療や、痛みを緩和する電気刺激技術や薬剤の開発に貢献する。