国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)電子光技術研究部門【研究部門長 森 雅彦】光センシンググループ 藤巻 真 研究グループ長、安浦 雅人 研究員は、下水の二次処理水などの夾雑物を含む試料中のごく少量のウイルスなどのバイオ物質を、夾雑物を除去しないでも高感度に検出できる外力支援型近接場照明バイオセンサー(EFA-NIバイオセンサー)を開発した。
今回開発したEFA-NIバイオセンサーは、検出対象のバイオ物質に磁気微粒子と光を散乱する微粒子を付着させて、磁石と近接場光により「動く光点」を作って検出を行う。従来法には無い「動き」という識別方法により、夾雑物が多い試料から極めて低濃度のバイオ物質を簡単な操作だけで検出できる。この手法による、都市下水の二次処理水200マイクロリットル(μl)にノロウイルス様粒子約80個を混入(濃度10 fg/ml程度)させた試料中からのウイルス様粒子検出に成功し、洗浄工程を省略しても従来法より数桁高い感度で検出できることが示された。EFA-NIバイオセンサーは、既存の技術では検出が難しかった環境中のごく微量のウイルスを簡便に検出でき、ウイルス感染予防への貢献が期待される。
なお、この成果の詳細は、学術雑誌Scientific Reports電子版に12月19日(英国時間)に掲載される。
 |
|
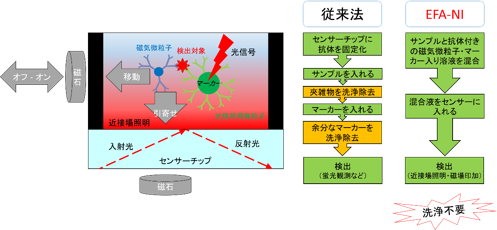
EFA-NIバイオセンサーの基本原理図(左)と必要な工程数の従来法との比較(右) |
|
左図中の赤いグラデーションが、入射光がセンサーチップ表面で全反射して生じた近接場光を示している。光を散乱する微粒子(マーカー)が近接場光を受けて光信号を発する。 |
世界の物流や交通規模の拡大、地球温暖化に伴い、感染症の爆発的な拡散や、広範囲にわたる食中毒などのリスクは増大している。身近なところでは、季節性インフルエンザウイルスやノロウイルスなどの感染症の拡大が挙げられるが、麻疹の再流行や、デング熱などのこれまでになかったウイルス感染症の国内上陸も社会問題化している。また、エボラウイルスのような致死率の高いウイルスに対する水際対策もより一層の強化が必要とされている。さらに、鳥インフルエンザや口蹄疫など家畜のウイルス感染症も問題となっている。ウイルス感染症の予防のため、環境中にあって感染する前の段階で検出できる技術が求められている。
ごく少数のウイルス粒子の検出には、ポリメラーゼ連鎖反応法(PCR法)が用いられているが、実験室の清浄な環境でしか使えない。また、イムノアッセイは、ごく少数のウイルスを検知するには感度不足であり、酵素結合免疫吸着法(ELISA)などの高感度なイムノアッセイは夾雑物が検出の妨げになるため、環境水などの試料では感度が出ない、操作が煩雑になるといった課題がある。
微量バイオ物質検出技術には、高感度と高選択性の両立が求められてきた。産総研では、従来のセンサー表面(2次元)を利用して検出対象を濃縮、高感度化するセンシングから脱却した、新しいセンシング技術による高感度なウイルスセンサーの開発を推進してきた。センサー表面に近い高さ数マイクロメートル(μm)の空間(3次元)を検出領域とすることで、表面を用いた濃縮効果による感度向上と、夾雑物の影響による感度・選択性の低下の回避を両立できると考え、今回の開発に取り組んだ。
なお、本研究開発の一部は、独立行政法人 日本学術振興会「科学研究費助成事業 基盤研究(A)/時間分解プラズモン励起発光イメージングを用いたノロウイルス検出システム研究(JP26246008)」による支援を受けて行った。
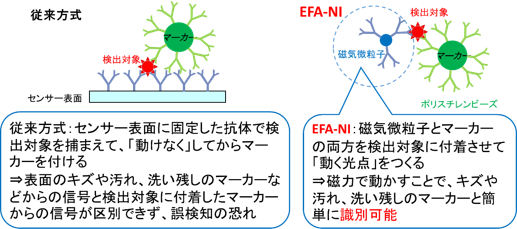
EFA-NIバイオセンサーは、センサーから高さ数マイクロメートルの空間だけを照らす近接場光と外部磁場を利用して、対象を「動く光点」にして検出するバイオセンサーである。EFA-NIバイオセンサーでは、検出対象のバイオ物質に対する抗体を、磁気微粒子と光信号用の微粒子につけて、両方をバイオ物質へ付着させる。外部の磁石によって、磁気微粒子が付着したバイオ物質は選択的に動かすことができる。光信号用の微粒子にはポリスチレンビーズを用いると近接場光を散乱するため、その散乱光を光信号とした。磁気微粒子は粒形が十分に小さいため、単体では近接場光を散乱しない。一方、ポリスチレンビーズ単体では磁力で動かない。このため、磁気微粒子とポリスチレンビーズの両方が付着したバイオ物質だけが、近接場光と外部の磁石によって「動く光点」となる。従来方式では、バイオ物質をセンサーの表面に捕まえて動けなくするが、EFA-NIバイオセンサーではバイオ物質を磁気微粒子で捕まえて動かすところが最大の特徴となっている。(図1)
 |
|
図1 従来方式の検出対象の捕捉方法(左)とEFA-NIバイオセンサーの検出対象の捕捉方法(右) |
今回、より明瞭に「動く光点」を観測するため、2つの工夫を行った。1つは、強度を100倍以上に増強できる導波モード励起機構による近接場光を用いた点である。光強度が増幅されるため、強い散乱光を観測でき、微粒子からの光信号の動きを動画として観察することができる。また、導波モード励起機構によって増強された近接場光は表面から1 μm程度までは入射光以上の強度で届くため、表面からやや浮いたポリスチレンビーズからも散乱光を観測できる。なお、一般的に利用される近接場光は100ナノメートル(nm)程度の距離までしか届かない。もう1つは、磁石をセンサーチップの横だけでなく裏側(下側)にも配置した点である。下側の磁石によって、磁気微粒子とポリスチレンビーズの両方が付着したバイオ物質をセンサー表面へ引き寄せて近接場光の範囲内に入れて光らせることができる。図2はEFA-NIバイオセンサーで観測される画像の模式図である。磁気微粒子とポリスチレンビーズの両方が付着した検出対象は外部の磁石によって動かされ、センサー表面に吸着した汚れやキズ、単体のポリスチレンビーズは、磁石によって動かないので簡単に区別できる。
 |
|
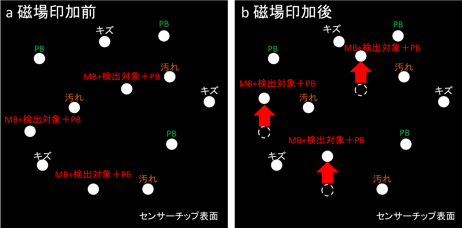
図2 EFA-NIバイオセンサーのバイオ物質検出方法の模式図 |
|
磁場を加える前(a)と後(b)の観測画像の例。図中のPBはポリスチレンビーズ、MBは磁気微粒子。 磁場の印加によって、PBとMBが付着した検出対象による光点が動く。 |
サンプル100 μl中に40個程度のノロウイルスのウイルス様粒子を加えた試料(濃度10 fg/ml程度)についてEFA-NIバイオセンサーで検出試験を行った(図3)。抗体付きの磁気微粒子とポリスチレンビーズが入った溶液と試料を混ぜてセンサーに入れ、磁場をかけて画像を撮影した。ポリスチレンビーズ単体や表面のキズ・汚れによるノイズは動かないが、磁気微粒子とポリスチレンビーズの両方が付着したウイルス様粒子は、「動く光点」として観測された。
 |
|
図3 ノロウイルスのウイルス様粒子検出の様子(磁場で移動した光点の軌跡を赤で表示) |
|
センサー上の約2.5×2.0mmの領域を一度に観測できるが、その視野の一部を拡大して表示。 |
さらに、都市下水の二次処理水200 μl中に80個程度のウイルス様粒子を混合した試料(濃度10 fg/ml程度)でも、ウイルス様粒子が検出できた。下水の二次処理水には多くの夾雑物が混ざり、それらがセンサー表面に付着して近接場光を散乱するため、多くのノイズ信号が観測される。しかし、これらは磁石では動かないため、磁気微粒子とポリスチレンビーズの両方が付着したウイルス様粒子を明確に識別できた。今回検出できたノロウイルス様粒子の濃度は、従来のイムノクロマトグラフィー法(1 ng/ml程度)や酵素結合免疫吸着法(10 pg/ml程度)で検出可能な濃度よりも3~5桁低い濃度である。また、洗浄を行わずに混入したウイルス様粒子を検出でき、EFA-NIバイオセンサーが、高感度と高い利便性を両立させていることが分かる。
現在、EFA-NIバイオセンサーの試作機を作製中であり、2017年の春ごろには、片手で持ち運びできる装置が完成する予定である。感染力の強いウイルスの感染予防を目標に、感度を1桁向上させて試料中に数個含まれるウイルスの検出をめざす。また、定量性を持たせるなど性能向上を図る。血中のバイオマーカーや環境中の汚染物質など幅広い分野で微量物質を検出できるセンサーシステムとして実用化を目指す。