独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)生物機能工学研究部門【部門長 巌倉 正寛】蛋白質デザイン研究グループ 巌倉 正寛 研究グループ長(兼務)、広田 潔憲 研究員、 分子細胞育種研究グループ 本田 真也 研究グループ長らは、AGCエスアイテック株式会社【代表取締役社長 森川 眞介】(以下「AGC-SI社」という)と共同で、抗体医薬の精製工程で用いられるクロマトグラフィー用の高性能アフィニティー担体(ビーズ)を開発した。
このアフィニティー担体は、シリカビーズ表面でリガンドタンパク質が配向しているため無駄がなく、抗体を高速に精製できる。副作用の少ない医薬品として期待されている抗体医薬品の製造において、高品質製造による安全性向上、低コスト生産に貢献できる。
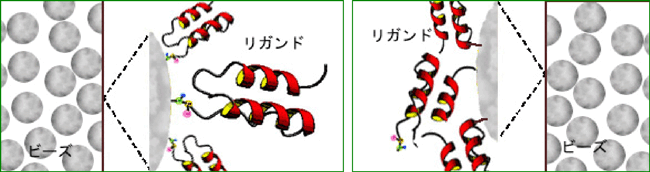 |
シリカビーズ上に多数のリガンドタンパク質が配向している高性能ビーズ
医療用の抗体の精製に威力を発揮する。 |
リガンドタンパク質がランダム配向している従来品 |
|
本技術の詳細は、2007年9月13~15日に北海道大学(札幌市)で開催される化学工学会第39回秋季大会で発表される。
抗体医薬は、抗体が生体内の異物を認識する性質を利用した医薬品で、患部のみをピンポイントで攻撃するので、副作用が少なく、従来タイプの医薬品では難しい難病の治療や、高い効能が期待されている。例えばヒト型モノクローナル抗体は、その薬効、副作用の低さなどから夢の治療薬として大きな期待がもたれ急速な勢いで市場が拡大している。
抗体医薬の製造において、抗体を生産する細胞である「DNA組換え型動物細胞」の改質や培養条件の至適化等の向上が目覚しく、この方面での研究開発は盛んに行われている。一方、製造される抗体医薬品の品質安全性および製造コストに大きく影響するダウンストリーム工程の研究は大きく遅れ、危機的状況である。プロセスにおいて使用される技術の多くが欧米由来であるため、国産技術の開発が望まれてきた。
抗体分子の分離精製にはアフィニティークロマトグラフィーという方法が用いられる。抗体分子を特異的に認識して結合するリガンドタンパク質をシリカビーズ等に固定化し、このビーズを充填したカラムを用いて抗体の精製を行う。抗体と不純物を含む水溶液をこのカラムに流すと抗体だけがリガンドタンパク質に捕捉される。捕捉された抗体は後ほど溶出液で溶出することができるので精製される。リガンドタンパク質としては抗体に結合する性質を有するプロテインAという微生物由来タンパク質が用いられているが、拡大する多品種の抗体に対応できなくなってきている。
生物機能工学研究部門では、タンパク質の固定化技術としての配向制御固定化技術の開発、抗体が認識して結合するタンパク質性リガンド分子の開発(タンパク質分子の再デザイン)を行ってきた。また、リガンド分子を固定化しておくためのシリカ系の担体基材の製造に関して国内トップクラスの技術を有するAGC-SI社と共同で、クロマトグラフィーとしての動的特性でも優れたアフィニティー担体(多数のリガンド分子が結合しているシリカビーズ)の開発に取り組んできた。
なお、本研究開発の一部は、独立行政法人 新エネルギー・産業技術総合開発機構の委託事業「新機能抗体創製技術開発/高効率な抗体分離精製技術(平成18~19年度)」による支援を受けて行ったものである。
抗体が分子の構造を認識して結合するリガンドタンパク質の設計を行った。リガンドタンパク質のアミノ酸配列を、抗体結合機能部分、固定化反応を効率よく行わせる部分、および製造工程においてリガンドタンパク質そのものを分離精製するのが容易になるように精製タグ配列部分に分割し、それぞれの部分配列ごとに各機能の最適化を行った。
今回作製したリガンドタンパク質は、まだプロトタイプの段階ではあるが、抗体との結合機能をもつアミノ酸配列としては、プロテインA由来のアミノ酸配列を元にした。これより数十個の変異体を作製し、抗体との結合能を保持したまま、固定化反応を阻害しないような最適の配列を得た。これに、ビーズ表面との距離をとるため適切な長さのリンカー配列、固定化反応のための活性化配列、および精製を容易にするための精製タグ配列を付与した。精製タグ配列により、製造工程においてリガンドタンパク質の分離精製が容易になり、効率よく純度の高いリガンドタンパク質の製造ができる。
このリガンドタンパク質を、AGC-SI社が開発しているシリカ系担体(ビーズ)に配向を制御して固定化した。この反応は既にわれわれが開発しているカルボキシ末端を介した配向制御型固定化方法を用いた。この方法を用いると担体表面にすき間なくリガンドタンパク質を固定化することができる。
開発したアフィニティー担体は、担体1mlあたり、抗体(IgG)分子を90mg結合させることができた。これは市販品に比べて1.8倍の結合能力(静的結合容量)である(図1)。
|
|
図1 アフィニティー担体の抗体結合能力(静的結合容量)の比較 |
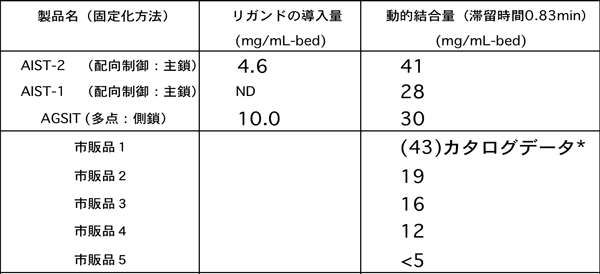
産業用の大量精製プロセスにおいては高速処理するために、抗体とリガンドとの接触時間が1分未満(実際は、0.83分という極めて短い時間)においても高い性能を発揮することが求められる。今回開発した担体は、担体1mlあたり、抗体(IgG)分子41mgの結合能力(動的結合容量)を示した。この値は、現在入手できる抗体精製用アフィニティー担体の中で動的結合容量の最も高い担体と同等であり、世界的にみても最高レベルの結合能力を引き出せたことを示している(下表)。
|
抗体精製用アフィニティー担体の動的能力の比較表 |
 |
|
*長カラムを用いており、他の測定と条件が異なる。使用実績は少ない。 |
比較表に示すように、AIST-2(配向制御:主鎖)ではリガンドタンパク質の配向を制御してシリカ担体(ビーズ)に固定化することにより、ランダムに多点結合する場合AGSIT(多点:測鎖)に比べて、固定化されたリガンドタンパク質の量が半分以下であっても、動的抗体結合量を1.3倍にあげることができている。これはアフィニティー担体のコストの大部分を占めるリガンドタンパク質の使用量を減らすことができるので、コスト面においても優れていることを意味する。
近年の抗体医薬品ブームは、アフィニティークロマトグラフィーが産業用にも幅広く利用される時代を予感させる。そのようなパラダイムシフトを起こすためには、精製対象物と強く結合するリガンドタンパク質を、必要なときにすばやくデザインして、供給できるデザインシステムの開発が重要と考えられる。産総研は、このようなパラダイムシフトを目指し研究開発を推進する。