日本発のゲノム編集ツールで新たな道を開く!

2024/05/01
日本発のゲノム編集ツールで新たな道を開く! ベンチャー、大企業、研究所がワンチームで新技術を開発

 ゲノム編集は、生物がもつゲノムの特定部位を狙って、DNA配列を改変する技術だ。すでに農作物の品種改良や医薬品開発など、さまざまな分野で広く活用されている。しかし、既存のゲノム編集ツールは、技術的に課題があるだけでなく、海外で特許を押さえられていることが多く、商業利用をするためには高額なライセンス料の支払いが必要になるなどの問題がある。国産のゲノム編集技術の開発が急がれる中、産総研は、TOPPAN株式会社(以下、TOPPAN)と株式会社インプランタイノベーションズ(以下、インプランタ)と共同で、新たなゲノム編集ツール「AalCas9」を開発した(2023/11/30プレスリリース)。植物細胞の操作と培養の高い技術を持つベンチャー企業であるインプランタと、印刷業を祖業としながらバイオを含めた情報処理の分野にも強みを持つTOPPAN、そして国立の研究機関である産総研の3者が共同で生み出した日本発のゲノム編集ツールである。このチームは、ゲノム編集ツールを細胞に導入するための「ウイスカー超音波RNP法」という独自技術の開発も進めている。今回新しく開発したゲノム編集技術は従来のものと比べて、どのような特徴や強みがあるのか。また、3者で研究開発を進めることにどのようなメリットがあるのか、それぞれの立場から話を聞いた。
ゲノム編集は、生物がもつゲノムの特定部位を狙って、DNA配列を改変する技術だ。すでに農作物の品種改良や医薬品開発など、さまざまな分野で広く活用されている。しかし、既存のゲノム編集ツールは、技術的に課題があるだけでなく、海外で特許を押さえられていることが多く、商業利用をするためには高額なライセンス料の支払いが必要になるなどの問題がある。国産のゲノム編集技術の開発が急がれる中、産総研は、TOPPAN株式会社(以下、TOPPAN)と株式会社インプランタイノベーションズ(以下、インプランタ)と共同で、新たなゲノム編集ツール「AalCas9」を開発した(2023/11/30プレスリリース)。植物細胞の操作と培養の高い技術を持つベンチャー企業であるインプランタと、印刷業を祖業としながらバイオを含めた情報処理の分野にも強みを持つTOPPAN、そして国立の研究機関である産総研の3者が共同で生み出した日本発のゲノム編集ツールである。このチームは、ゲノム編集ツールを細胞に導入するための「ウイスカー超音波RNP法」という独自技術の開発も進めている。今回新しく開発したゲノム編集技術は従来のものと比べて、どのような特徴や強みがあるのか。また、3者で研究開発を進めることにどのようなメリットがあるのか、それぞれの立場から話を聞いた。
従来のゲノム編集技術における課題
ゲノム編集とは、DNA上の狙った場所を切断し、切断されたDNAが修復される機構を利用して、遺伝子を書き換える技術だ。ゲノム編集にはいくつかの種類があり、現在もっとも広く使われている技術は、2020年にノーベル化学賞の受賞対象になった「CRISPR/Cas9(クリスパー・キャスナイン)」である。これは、DNAを切断するハサミ役の「Cas9」と、Cas9を狙った場所へと導く案内役の「ガイドRNA」がセットになって働く仕組みになっている。ガイドRNAの種類を変更することで、さまざまな部位を編集のターゲットにすることができ、その簡便さと編集効率の良さからスタンダードなゲノム編集技術として急速に広まった。(産総研マガジン「ゲノム編集とは?」)
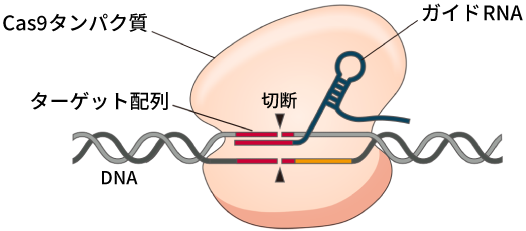 CRISPR/Cas9によるゲノム編集の仕組み。ガイドRNAがターゲットとするDNA配列を認識し、その部位をCas9タンパク質が切断する。切断された後は、生物に備わっている修復機構によって修復され、その際に変異が導入される。
CRISPR/Cas9によるゲノム編集の仕組み。ガイドRNAがターゲットとするDNA配列を認識し、その部位をCas9タンパク質が切断する。切断された後は、生物に備わっている修復機構によって修復され、その際に変異が導入される。
ただ、このCRISPR/Cas9も万能の技術ではない。意図しない部位を誤って切断してしまうリスクや、ターゲットにできるDNAの領域に制限があることなどの課題がある。また、CRISPR/Cas9は海外で特許が押さえられており、日本企業が商業目的で利用する場合には、高額な特許ライセンス料が必要になる。こうした背景から、既存技術の特許に抵触しない新たなゲノム編集ツールの開発が切望されていた。
3者がワンチームで挑戦した新ゲノム編集ツールの開発
インプランタは、もともと産総研の植物機能制御研究グループと共同で、植物の遺伝子制御技術などの開発をしてきた。同社は植物の受託研究を行っており、植物研究における最先端の技術基盤を整えている。
「2013年頃から植物研究でもゲノム編集が注目されるようになり、当社では既存のゲノム編集ツールをいち早く導入しました。ですが、やはり企業が商業利用するにはコストやライセンスの問題からハードルが高い。そのため、国産で独自のゲノム編集技術を開発し、一日も早く実用化したいという思いがあり、産総研と共同で研究を進めてきました」と同社代表取締役の寺川輝彦は語る。
さまざまな事業を手掛けるTOPPANもゲノム編集を用いた事業展開に強い関心をもっていた。同社は、バイオの実験で用いるマイクロアレイ(数万から数百万のDNA断片をガラスなどの基板上に高密度に配置し、一度に解析するためのツール)の製造に同社の印刷技術を活用するなど、バイオ分野とも関わりが深い。また、遺伝子検査やクレジットカードの製造・発行事業などを通して、遺伝情報をはじめとする膨大な個人情報をセキュアに管理したり、AI技術を用いてデータマイニングをしたりするなど、特定のIT分野にも強い。同社情報コミュニケーション事業本部の伊藤誠一郎は「ゲノム編集の技術開発は世界的に競争が激しいので、そこで勝つのは簡単ではありません。ですが、当社が培ってきたデータ解析のノウハウは、競合の中で抜きんでるための一つの強みになるのではないかと考え、インプランタの寺川さんと議論を深めてきました」と言う。
産総研とTOPPANの双方とつながっていた寺川は、産総研とともに培ってきた遺伝子制御技術などの研究ノウハウと、TOPPANのデータ解析技術を組み合わせることで、独自のゲノム編集ツールの開発に向けて勝機を見出だせるのではないかと考えた。こうして寺川が産総研とTOPPANの橋渡しをすることで、3者の共同研究が実現したのだ。
既存のゲノム編集では狙えない領域をターゲットにできる
共同研究を進めてきた結果、インプランタ、TOPPAN、産総研の共同チームは、新たなゲノム編集ツール「AalCas9」を生み出した。AalCas9の特徴について、産総研生物プロセス研究部門 主任研究員の中村彰良は、「Cas9は、DNAのどの部分でも切断できるわけではなく、PAM配列と呼ばれる、特定の塩基配列の近くしか切断できません。この部分を切断したいと考えたとしても、その近くに必ずしもPAM配列があるとは限らないので、編集対象にできる領域に制約があるのです。今回開発したAalCas9は、現在広く使われているCas9とは異なるPAM配列を認識するため、これまで編集できなかった領域でも、ゲノム編集のターゲットにできる可能性があります」と話す。
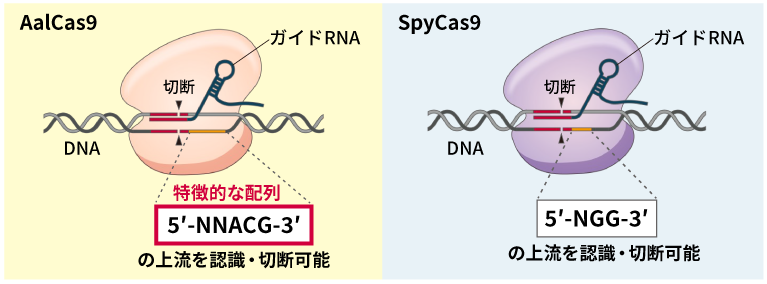 AalCas9は、既存のゲノム編集ツールのCas9(SpyCas9)と異なるPAM配列を認識する。
AalCas9は、既存のゲノム編集ツールのCas9(SpyCas9)と異なるPAM配列を認識する。
DNAは、アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の4種類の塩基の配列で構成され、これが遺伝情報となっている。現在広く使われているCas9である、SpyCas9のPAM配列は「5’-NGG-3’」(NはA、T、G、Cどの塩基でもよい)だが、AalCas9のPAM配列は「5’-NNACG-3’」である。「PAM配列の塩基の数で比較すれば、AalCas9の方が多いので、ゲノム上に存在する頻度は5’-NGG-3’より少なくなり、編集対象にできる範囲は多少狭まります。しかし、見方を変えれば、Cas9が認識する塩基の数が多いことで特異性が高くなり、意図しない場所を誤って切断するリスクを抑えることができます」と中村はAalCas9の強みを語る。
何十万の微生物候補から特徴のあるCas9を選別
どのようにして既存のゲノム編集ツールとは異なるPAM配列のCas9を見つけることができたのだろうか。CRISPR/Cas9は、もともと微生物がもつ免疫の仕組みから発見されたものだ。現在広く使われているCRISPR/Cas9では、化膿性レンサ球菌(Streptococcus pyogenes)という微生物がもつCas9(SpyCas9)が利用されている。PAM配列は微生物の種類によって異なるため、まずは、微生物のデータベースから候補となる微生物をピックアップした。この工程はTOPPANが担った。同社が培ってきたデータ解析のノウハウを生かし、公共の微生物データベースを探索したのだ。TOPPANの伊藤は次のように話す。
「データベースでCas9遺伝子をもつ可能性のある微生物を検索すると、何十万という微生物がヒットします。しかし、そのうちのかなりの微生物が、既存技術の特許の範囲内に入ってしまいます。そこで、普遍的に存在する微生物ではなく、低温や高温の場所など特殊な環境に生息する微生物であれば、既存技術の特許に抵触しない、特徴的なCas9遺伝子を持つ微生物が見つかるのではないかと考え、深海や温泉地、噴火口などに生息する微生物に着目して候補を絞り込みました」
こうして40~50種類の微生物をピックアップした。データベースには遺伝情報である塩基配列のデータしかないため、選んだ微生物のCas9がどんなPAM配列を認識するか、また実際に細胞内で高い活性を示すかは、実験して調べてみないとわからない。そこで次のステップとして、候補として選んだ微生物のCas9の機能を調べた。この工程は、産総研の中村と、同グループ主任研究員の菅野茂夫が行った。中村はRNAやタンパク質の生産・精製を得意とし、菅野はCRISPR/Cas9がゲノム編集ツールとして報告された2013年からゲノム編集の研究をしてきた。2人はそれぞれの強みを生かし、中村が候補微生物のCas9タンパク質とガイドRNAの複合体の生産・精製を行い、菅野がそれを植物や動物の細胞に導入して、PAM配列や活性を調べた。
「40~50の候補微生物に対して、それぞれの微生物がもつCas9がどんなPAM配列を認識するか、1つ1つ確かめるための実験系を作りました。この実験系を使って評価した結果、深海堆積物中に生息する微生物Abyssicoccus albusがもつCas9が、有力なゲノム編集ツールになり得ることがわかったのです」と中村は地道な研究の成果を説明する。
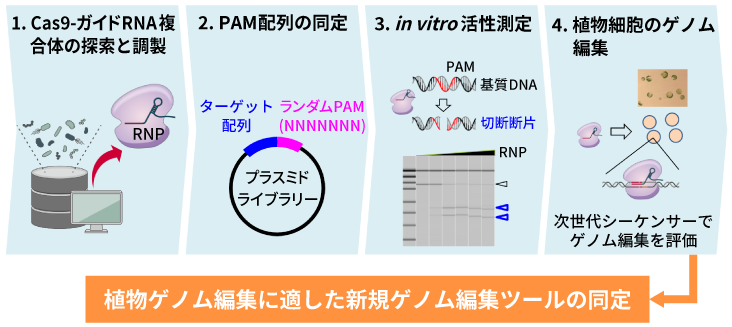 Cas9の機能を調べるための実験系。データベースからガイドRNAとCas9タンパク質の複合体(Ribonucleoprotein、RNP)を選別し、実際に調製したRNPを用いてPAM配列を同定する。調製したRNPでDNAが切断できるかどうかを確認した後、実際の植物を用いたゲノム編集を行い、次世代シーケンサーでゲノム編集機能を評価する。
Cas9の機能を調べるための実験系。データベースからガイドRNAとCas9タンパク質の複合体(Ribonucleoprotein、RNP)を選別し、実際に調製したRNPを用いてPAM配列を同定する。調製したRNPでDNAが切断できるかどうかを確認した後、実際の植物を用いたゲノム編集を行い、次世代シーケンサーでゲノム編集機能を評価する。
次の工程として、同定したAalCas9を実際にゲノム編集に使ったときに、実用に足る性能を備えているかどうかを検証する必要がある。その検証は、インプランタの寺川が担当した。インプランタは、既存のゲノム編集ツールを用いて、ゲノム編集植物の作製や解析評価を行っている。寺川らは、シロイヌナズナとイネを用いて、AalCas9によるゲノム編集を行ったところ、ゲノム編集株が得られることを実証した。
「AalCas9は、いわば何十万という候補の中のチャンピオンです。現在、AalCas9のゲノム編集ツールとしての効率や使い勝手を詳細に調べているところですが、既存のゲノム編集ツールと同程度の効率で使うことができることがわかってきました。ただし、植物の種類によってゲノム編集の効率は変わってくるので、どういう植物のゲノム編集に適しているかなども調べています」と寺川は言う。
ゲノム編集ツールを細胞に導入するための独自技術
実際にゲノム編集を行うためには、Cas9とガイドRNAを植物や動物の細胞内に導入する必要がある。このときに、どうやってこれらを細胞内に入れるかも重要なポイントだ。
インプランタは、DNAを直接的に植物の細胞内に届ける「ウイスカー超音波法」という独自技術をもっている。これは、「ウイスカー」というマイクロサイズの「針」を用いて植物細胞に孔を開け、超音波を当てることで、DNAを細胞内に導入する方法だ。これまではDNAのみ導入が可能だったが、産総研とTOPPANが開発に加わり、ゲノム編集ツールであるCas9とガイドRNAの複合体を細胞に導入できるようにこの技術を発展させ、これを「ウイスカー超音波RNP法」と名付けた(RNPはCas9とガイドRNAの複合体を意味する)。
「新たなゲノム編集ツールであるAalCas9と、それを細胞に導入するためのウイスカー超音波RNP法を組み合わせることで、日本独自のゲノム編集技術として実用化を目指したい」と寺川は意気込みを語る。
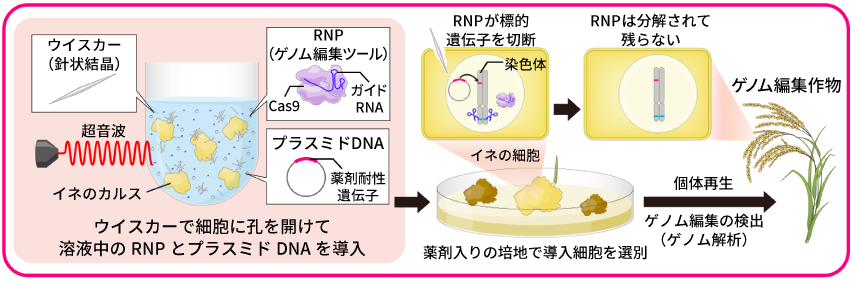 ウイスカー超音波RNP法の概要。ウイスカー(針)で細胞に孔を開け、Cas9とガイドRNAの複合体(RNP)を導入し、導入された細胞を選別し、ゲノム編集作物をつくる。プラスミドDNAは、導入された細胞を選別するために用いる。
ウイスカー超音波RNP法の概要。ウイスカー(針)で細胞に孔を開け、Cas9とガイドRNAの複合体(RNP)を導入し、導入された細胞を選別し、ゲノム編集作物をつくる。プラスミドDNAは、導入された細胞を選別するために用いる。
国産ゲノム編集ツールの事業化に向けて
3者は、新しく開発したゲノム編集ツールAalCas9の特許をすでに取得しており、事業化は目前だ。ポスドク時代からゲノム編集の研究をしてきた菅野は、産総研でこの共同研究に携わり、「とても整理された環境で研究ができている」と言う。
「このプロジェクトは最初から事業化することが目標として定まっていて、強力な共同研究体制になっています。TOPPANのデータ解析で研究が加速し、また、インプランタがもつゲノム編集関連のノウハウによって、実際に使える技術であることまで示せたのは、この共同研究のチームワークがあったからこそだと思います」と3者共同で研究を進めてきたメリットについて語る。
寺川は事業化に意欲を見せる。
「当社は国内でいち早く既存のゲノム編集ツールを使ったサービスを開始しました。ゲノム編集に興味をもたれている企業は多いのですが、やはり高額なライセンス料がかかることがハードルになっています。AalCas9のプレスリリースが出てから、問い合わせが増えているので、状況が整えばすぐにでもAalCas9に切り替えていきたいと考えています」
また、AalCas9を広く一般に使ってもらうために、伊藤は次のように話す。
「医薬品の研究開発費は、通常であっても、非常に高額になります。ゲノム編集を使いたいけれど、製品化の段階で高額なライセンス料が請求され得ることを考えると着手できないという声も聞きます。そのような懸念をもたれることなく、多くの人にAalCas9を使ってもらえるような仕組みづくりを提案していきたい。一つのアイデアとして、製品化に成功した後、売り上げの何%をライセンス料とするといったことも検討していきたいと考えています」
AalCas9は、植物だけでなく、ヒトの培養細胞でも既存のゲノム編集ツールと同程度の効率でゲノム編集が可能なため、医療分野への応用も期待できる。さらに、AalCas9は既存のCas9に比べて、分子サイズが小さいことも特徴の一つだ。
「新たな治療法としてゲノム編集ツールを標的細胞に届けるドラッグデリバリーなどの手法が検討されています。このような場合は、分子サイズが小さい方が好ましいので、AalCas9が使えるかもしれない。このように、これまでのゲノム編集ツールでは不可能だった技術が、今回開発したAalCas9によって現実になるかもしれません」と伊藤はこの技術への期待を語る。
 新たな戦力として加わったTOPPANの田頭尚美(写真右)と倉田佑里(写真中央)。田頭はITに強く、倉田は生物学のバックグラウンドがある。共同研究成果の事業化に向けて、技術のさらなる改善などに取り組んでいる。
新たな戦力として加わったTOPPANの田頭尚美(写真右)と倉田佑里(写真中央)。田頭はITに強く、倉田は生物学のバックグラウンドがある。共同研究成果の事業化に向けて、技術のさらなる改善などに取り組んでいる。
応用範囲が広く、簡便に使うことのできるゲノム編集ツールは、農業・医療・工業など、さまざまな業界で待ち望まれている。AalCas9の開発チームは、技術を作って終わりではなく、ビジネスまでを見据えた一気通貫のパッケージを、3者それぞれの強みを持ち合わせながら創り上げようとしている。AalCas9の実用化によって、既存ツールでは成し得なかった新たな技術の開発が、幅広い分野で進む可能性があるだろう。
まずはゲノム編集に関心はあるが、特許料が高く、使用に躊躇しているような企業に使ってもらいたい。新たなゲノム編集で産業の未来を切り拓く、彼らの挑戦は続いていく。
TOPPAN株式会社
情報コミュニケーション事業本部
フロンティア事業開発センター
伊藤 誠一郎
Ito Seiichiro
生物プロセス研究部門
植物機能制御研究グループ
主任研究員
中村 彰良
Nakamura Akiyoshi
株式会社インプランタイノベーションズ
代表取締役
寺川 輝彦
Terakawa Teruhiko
生物プロセス研究部門
植物機能制御研究グループ
主任研究員
菅野 茂夫
Sugano Shigeo
TOPPAN株式会社
株式会社インプランタイノベーションズ
産総研
生命工学領域
生物プロセス研究部門